Farmaceutická strategie pro Evropu. V centru všeho dění musí být pacient

Evropská léková legislativa musí reagovat na vývoj léčebných možností, nerovný přístup pacientů k nejmodernějším lékům a postupné snižování konkurenceschopnosti Evropy na globálním trhu. O tom, jak obrátit kormidlo vývoje moderních léčiv v Evropě žádoucím směrem, diskutovali odborníci na bruselské konferenci o návrhu nové Farmaceutické strategie pro Evropu, která by mohla spatřit světlo světa na jaře příštího roku. Cílová rovinka je ale ještě stále v mlze, v EU zatím probíhá teprve interní posuzování.
Asociace inovativního farmaceutického průmyslu (AIFP) uspořádala v Bruselu pod záštitou českého předsednictví v Radě EU po červnovém pražském setkání již druhou mezinárodní konferenci k jednomu z nejdůležitějších evropských zdravotnických témat současnosti – novelizaci evropských lékových předpisů. Nová pravidla podle odborníků velmi významně ovlivní dostupnost moderních léčiv pro evropské pacienty, a to na řadu dalších let. V nové lékové legislativě ale nepůjde pouze o nastavení podmínek poskytování zdravotních služeb a dostupnost inovativních léků, ale i o posílení konkurenceschopnosti Evropy v globálním měřítku. Ta se v posledních letech podle AIFP zhoršuje. V Evropě v současnosti vzniká pouze 22 procent z celkového objemu inovativních léčiv, což vynikne především v kontrastu s Spojenými státy americkými, kde je to 48 procent. Podle ředitelky Evropské federace farmaceutického průmyslu a asociací (EFPIA) Nathalie Mollové je nová revize právních předpisů EU v oblasti léčiv šancí, jak tento trend zvrátit. „Máme příležitost vytvořit globálně konkurenceschopný politický ekosystém, který podporuje inovace,“ uvedla Nathalie Mollová. V tomto ohledu bude dle jednotlivých diskutujících klíčové nalezení rovnováhy mezi požadavkem na co nejvyšší atraktivitu Evropské unie pro investice do výzkumu a vývoje nových léčiv – tedy systémem farmaceutických pobídek a ochranou práv duševního vlastnictví – a požadavkem na rychlý přístup pacientů k nové léčbě. A právě zájem pacientů byl v centru diskuse bruselské konference AIFP.
Klíčová je tvorba cen
Odpovědnost za zajištění dostupnosti nejmodernějších léků pro pacienty přitom mají politici i zástupci farmaceutického průmyslu. „Základní myšlenkou je zajistit pro každého co nejlepší možný přístup k nejlepší léčbě, nejnovějším inovacím, ale také například zdravotnickým prostředkům. Zkrátka všemu, co je nutné k tomu, aby se s pacientem dobře zacházelo. To má samozřejmě velký dopad na státní rozpočet. A my si uvědomujeme, jak je současná situace pro jednotlivé země rozpočtově složitá a že tento náš zájem může být někdy v Evropě v určitém konfliktu,“ řekl ve svém úvodním slově náměstek ministra zdravotnictví Jakub Dvořáček, podle kterého je stěžejní nastavit systém tak, aby byl transparentní, pracoval pro pacienty a zároveň byl udržitelný pro rozpočet. V této oblasti byla podle Dvořáčka Evropa v uplynulých letech ve srovnání se světem úspěšná. „Věřím, že máme nejlepší přístup k léčbě na světě,“ pravil Dvořáček. Podle výkonného ředitele AIFP Davida Koláře se ale prostředí na trhu mění a na to je potřeba reagovat. To potvrzuje i Jakub Dvořáček. „Když se ohlédneme zpět do minulosti, tak před patnácti lety jsme dodávali inovativní léky v hodnotě tisíců eur na pacienta, před deseti lety už to byly desítky tisíc eur. Dnes máme léky s cenou dva a půl až tři miliony eur na pacienta. Můžeme si to ale dovolit? To je velká otázka,“ řekl Dvořáček, podle něhož bude mít Česká republika velký problém takto drahé léky pacientům zaplatit. „Musím říci, že v zemích, jako je Česká republika, si to dovolit nemůžeme. A ne proto, že bychom nechtěli. Myslím si, že Česká republika má velmi otevřený postoj k inovacím, ale my to prostě nebudeme schopni zaplatit,“ vysvětlil náměstek českého ministra zdravotnictví a nastínil tak jeden z hlavních problémů, který má pomoci vyřešit nová Farmaceutická strategie pro Evropu. „Je důležité, abychom udrželi v Evropě výrobu, abychom udrželi výzkum a vývoj nových léků. To si sice myslím, že velmi dobře funguje, ale jistě můžeme udělat spoustu věcí, jak to ještě zlepšit. Jsem ale toho názoru, že nikdo jiný než farmaceutický průmysl nemůže přinést řešení cenotvorby. Pokud chceme mít v budoucnu v Evropě inovace, je třeba něco změnit,“ uzavřel Dvořáček.
Jak zvýšit dostupnost a podpořit inovace?
Jak tedy může revize obecných farmaceutických právních předpisů podpořit přístup pacientů k léčbě a podpořit inovace? Revize unijní legislativy, resp. nová Farmaceutická strategie pro Evropu byla jako záměr přijata už v listopadu 2020 a obsahuje více než 50 různých legislativních i nelegislativních opatření. Všechna mají za cíl vylepšit pozici pacientů co do přístupu k nejmodernějším lékům a současně vytvořit v Evropě takové politické prostředí, které bude podporovat jejich výzkum a vývoj. Neméně důležité je ale také harmonizovat pravidla pro přístup pacientů k inovativní léčbě v jednotlivých zemích. Tím by se měly zásadně omezit nerovnosti v přístupu pacientů k léčbě.
Riziko pro výzkum, vývoj a přístup pacientů k inovacím by podle šéfky EFPIA Nathalie Mollové mohl představovat rámec, který by počítal s podmíněnými pobídkami, neúměrnými závazky pro firmy a sníženými pobídkami pro výzkum a vývoj. Podle šéfky EFPIA má však nyní Evropa šanci vydat se cestou budování globálně konkurenceschopného politického ekosystému podporujícího inovace. „Evropa se může stát skutečným světovým lídrem v oblasti lékařských inovací pouze prostřednictvím regulačního rámce odolného vůči budoucnosti a robustního a předvídatelného ekosystému duševního vlastnictví a pobídek,“ upozornila Nathalie Mollová.
Kde zaostáváme?
Evropa za Spojenými státy americkými nezaostává, pouze pokud jde o inovační potenciál, ale výrazně také v oblasti schvalování nových účinných látek (NAS). Zatímco Evropské lékové agentuře (EMA) zabralo podle dat z roku 2021 schválení NAS 428 dní, americkému Úřadu pro kontrolu potravin a léčiv (FDA) jen 245 dní. Podle Nathalie Mollové je to mimo jiné způsobeno i tím, že využití možností pro zrychlený přístup pacientů k inovacím u tzv. unmet medical needs, tedy nenaplněných zdravotních potřeb, je v Evropě ve srovnání se světem relativně skromné. Přitom podle EFPIA má Evropa účinné nástroje na zrychlený přístup k lékům. Jde například o program PRIME, který EMA zahájila již v roce 2016 právě za účelem podpory vývoje léků na neuspokojené zdravotní potřeby a zrychlení jejich hodnocení a následné distribuce k pacientům, kteří je potřebují.
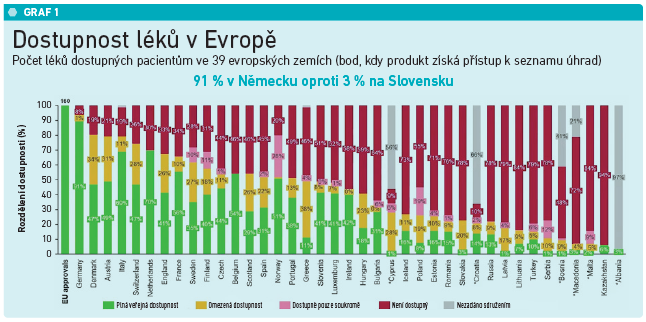
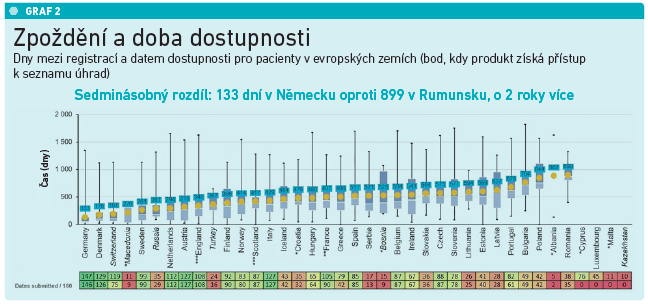
„Pro nikoho nemůže být přijatelné, aby byl jeho přístup k lékům založen na tom, jakou má národnost. To v žádném případě,“ poznamenala Nathalie Mollová, přičemž odkázala i na data dokazující nerovnosti k přístupu k moderním lékům v rámci Evropy. Zatímco v Německu je ve stejnou dobu dostupných 91 procent inovativních léků, na Slovensku pouze tři procenta (viz graf 1). A podobně alarmující nerovnost panuje dle šéfky EFPIA i v dobách mezi registrací nového léku a stanovením úhrady. Zatímco v Německu tento proces zabere 133 dní, v Rumunsku čekají pacienti 899 dní, tedy o více než dva roky déle než Němci (viz graf 2). „To není přijatelné nejen pro pacienty, regulační orgány a politiky, ale ani pro průmysl. Takto prostě nevypadá úspěšný model,“ zdůraznila Nathalie Mollová.
Příčiny problému
Podle Nathalie Mollové nelze spoléhat na to, že revize evropských lékových předpisů vyřeší hned všechny naše problémy. Otázku dostupnosti léčiv je proto potřeba řešit i mimo rámec revize. Indicií poukazujících na to, že Evropa má skutečný problém, je dost. Podle EFPIA existuje mnoho důkazů o velkých rozdílech v dostupnosti a zpoždění přístupu pacientů k inovativním lékům v celé Evropě, ale jen velmi málo důkazů, že by se tato zpoždění zkracovala. Spíše je tomu naopak. I v jedné zemi mohou pacienti získat přístup k některým lékům takřka okamžitě a na jiné čekat i roky. A přestože se zdá, že například přístup k onkologickým lékům se zlepšuje, dostupnost léků na vzácná onemocnění se v jednotlivých členských státech stále velmi liší. EFPIA se proto pokusila identifikovat hlavní příčiny těchto nerovností a našla deset vzájemně souvisejících faktorů, kterými si farmaceutický průmysl vysvětluje současný stav. Některé z nich jsou dle Nathalie Mollové odpovědností průmyslu, další jsou zakořeněny v systémech schvalování léčiv a procesech v jednotlivých členských státech EU, které ovlivňují obchodní rozhodování. Jiné se pak podle EFPIA týkají spíše politického ekosystému, který následně ovlivňuje obchodní rozhodnutí. Tady je tedy patrná ona dělená odpovědnost průmyslu a politiků. Řešení tedy podle EFPIA vyžaduje, aby spolu obě strany maximálně komunikovaly.
Co udělá pro změnu farmaceutický průmysl?
Farmaceutický průmysl si podle EFPIA uvědomuje svůj díl odpovědnosti a skutečnost, že nelze čekat na kompletní dokončení revize lékových předpisů. Přináší proto vlastní sadu konkrétních návrhů, které mají zlepšit dostupnost inovativních léčiv pro evropské pacienty nezávisle na revizi evropských lékových předpisů, na jejichž finální podobu můžeme ještě dlouho čekat. V první řadě tedy ředitelka EFPIA Nathalie Mollová připomněla dubnový příslib farmaceutického průmyslu, že bude podávat žádosti o uvedení nových léčiv ve všech členských státech EU, ve kterých je to dle místních předpisů možné, a to do dvou let po registraci. Mezi další návrhy farmaceutického průmyslu patří například zavedení databáze s průmyslovými informacemi o stavu uvedení přípravků na trh či návrh na rozdílné ceny stanovené s ohledem na ekonomické možnosti jednotlivých států EU.
Klíčová schopnost sdílet data
Významná část diskuse byla také věnována Evropskému prostoru pro zdravotní data (EHDS). Právě ten má zlepšit a zrychlit poskytování péče napříč EU a také pomoci uspíšit výzkum nových terapií v EU. EHDS by měl přispět také k přesnějšímu a nákladově efektivnímu hodnocení přínosu nových technologií a léčiv pro zdraví Evropanů. Zde je dle diskutujících možné opřít se o nové nařízení o HTA, tedy hodnocení zdravotnických technologií, které se aktuálně implementuje a k jehož maximální podpoře se zavázal i farmaceutický průmysl. I to by mělo zásadním způsobem urychlit přístup pacientů k novým zdravotnickým technologiím, a to včetně léčivých přípravků. Podle výkonného ředitele AIFP Davida Koláře představuje EHDS nejdůležitější legislativu, o které se v současnosti diskutuje, a je to také nejdůležitější část z pohledu českého předsednictví.
„Data jsou podstatnou součástí a nezbytným základem pro jakýkoli druh vylepšení nebo změn systému. Cenová dostupnost léků je jistě jedním z klíčových principů, které je třeba brát v úvahu, ale bez dat jsme slepí. Co se týká přístupnosti dat, tak se úroveň v jednotlivých státech velmi liší,“ upozornil šéf AIFP s tím, že vytvoření společného datového prostoru sice nevyřeší všechny evropské problémy v lékové politice, je to ale základ, na kterém lze stavět. „Mohlo by to významně přispět k zacelení propasti mezi státy a vytvořit základní rámec, který nám může do budoucna pomoci,“ uzavřel Kolář.
Cílová rovinka stále v mlze
Kdy se tedy pacienti, průmysl i regulátoři dočkají novelizace evropských lékových předpisů? Podle původního plánu nová pravidla měla spatřit světlo světa již v prosinci tohoto roku. Antonios Rodiadis z generálního ředitelství Evropské komise pro zdraví a bezpečnost potravin však naznačil, že si možná budeme muset počkat přeci jen o něco déle. „Teď se nacházíme v procesu vnitřní kontroly. Děláme spoustu kroků současně, posuzujeme návrhy právních předpisů i jejich dopady. Jakmile tato kontrola skončí, přejdeme do fáze přijímání,“ vysvětlil Rodiadis s tím, že se tak stane v následujících měsících. „Přesný den vám říci nemohu. Jde o vysoce kvalitní návrh, který přichází jednou za patnáct let,“ zdůraznil Antonios Rodiadis význam nových pravidel s tím, že cílem je schválit kompletní revizi farmaceutické legislativy EU ještě současným Evropským parlamentem. Volby do Evropského parlamentu přitom mají proběhnout v roce 2024. Z hlediska českého předsednictví je však již nyní jisté, že se do konce roku nestihne nařízení o lécích na vzácná onemocnění a pediatrických lécích. „Bohužel, české předsednictví nedostane šanci zasáhnout do nařízení o lécích na vzácná onemocnění ani pediatrických léků,“ potvrdil náměstek ministra zdravotnictví Jakub Dvořáček s tím, že to již budou řešit pravděpodobně na jaře příštího roku Švédové, kteří po České republice předsednictví přebírají.