Další revoluce v léčbě CML
Jednou z prací, které byly na letošním zasedání ASCO prezentovány v prestižní sekci late‑breaking sdělení, je studie ASC4FIRST. Jejím hlavním závěrem je, že asciminib prokázal vyšší účinnost s příznivým profilem bezpečnosti ve srovnání se standardními tyrosinkinázovými inhibitory u dospělých s nově diagnostikovanou chronickou myeloidní leukémií. Jde o statisticky i klinicky významný výsledek.
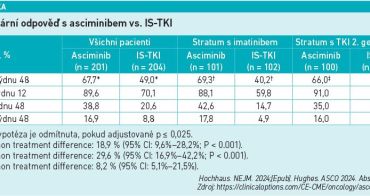
Do studie fáze III ASC4FIRST byli zařazeni pacienti s nově diagnostikovanou chronickou myeloidní leukémií s pozitivním Philadelphia chromozomem v chronické fázi (Ph+ CML‑CP). Asciminib zde naplnil oba primární cílové parametry. Prokázal vyšší míru MMR (major molecular response – velká molekulární odpověď) ve 48. týdnu ve srovnání se standardním inhibitorem tyrosinkinázy (imatinib, nilotinib, dasatinib nebo bosutinib) vybraným zkoušejícím (67,7 % vs. 49,0 %) a také ve srovnání se samotným imatinibem (69,3 % vs. 40,2 %) (viz tabulku).
Asciminib rovněž prokázal příznivý profil bezpečnosti a snášenlivosti ve srovnání s imatinibem a TKI druhé generace s menším počtem nežádoucích účinků stupně ≥ 3, úprav dávek a polovičním počtem nežádoucích účinků vedoucích k přerušení léčby.
„Asciminib je první léčbou CML, která vykazuje výrazně lepší účinnost ve srovnání s TKI, které jsme využívali už po léta,“ uvedl profesor Tim Hughes, South Australian Health & Medical Research Institute, a dodal: „Získáváme tak velmi slibnou potenciální možnost léčby první linie pro nově diagnostikované pacienty, a zvyšujeme tím pravděpodobnost, že dosáhnou terapeutických cílů.“
O klinickém hodnocení fáze III ASC4FIRST
ASC4FIRST (NCT04971226) je multicentrická, otevřená, randomizovaná, head‑to‑head studie fáze III, srovnávající asciminib 80 mg podávaný perorálně jednou denně s TKI první nebo druhé generace (imatinib, nilotinib, dasatinib nebo bosutinib) vybraným zkoušejícím u 405 dospělých pacientů s nově diagnostikovanou Ph+ CML‑CP. Studie má dva primární cílové parametry:
- porovnání účinnosti asciminibu se standardním TKI vybraným zkoušejícím,
- porovnání účinnosti ve srovnání s TKI ve skupině účastníků s imatinibem (TKI vybraný před randomizací na základě podílu pacientů, kteří dosáhnou MMR ve 48. týdnu).
 Hlavními sekundárními cílovými parametry jsou podíl pacientů, kteří dosáhnou MMR v 96. týdnu, a cílový parametr bezpečnosti, tj. ukončení léčby z důvodu nežádoucích účinků do 96. týdne. Dalšími sekundárními cílovými parametry jsou bezpečnost a účinnost, včetně MMR, MR4, MR4,5, kompletní hematologické odpovědi a BCR::ABL1 ≤ 1 % ve všech plánovaných časových bodech sběru dat; délky trvání a doby do první MMR, MR4 a MR4,5; doby do selhání léčby; přežití bez příhod, přežití bez selhání, přežití bez progrese a celkového přežití.
Hlavními sekundárními cílovými parametry jsou podíl pacientů, kteří dosáhnou MMR v 96. týdnu, a cílový parametr bezpečnosti, tj. ukončení léčby z důvodu nežádoucích účinků do 96. týdne. Dalšími sekundárními cílovými parametry jsou bezpečnost a účinnost, včetně MMR, MR4, MR4,5, kompletní hematologické odpovědi a BCR::ABL1 ≤ 1 % ve všech plánovaných časových bodech sběru dat; délky trvání a doby do první MMR, MR4 a MR4,5; doby do selhání léčby; přežití bez příhod, přežití bez selhání, přežití bez progrese a celkového přežití.
Studie nadále probíhá, další plánovaná analýza bude provedena v 96. týdnu, kdy bude vyhodnocen klíčový sekundární cílový parametr (MMR v 96. týdnu) a další sekundární cílové parametry.
Více o asciminibu
Asciminib je první lék na CML, jehož účinek je dán specifickou vazbou na myristoylovou kapsu ABL (v odborné literatuře označován jako inhibitor STAMP). Aktuálně schválené léčebné přípravky k léčbě CML jsou TKI, které se zaměřují na vazebné místo ATP (ATP‑kompetitivní). Asciminib je schválen ve více než 70 zemích včetně USA a EU k léčbě dospělých s Ph+ CML‑CP, kteří byli dříve léčeni dvěma nebo více TKI. V některých zemích, včetně USA, je schválen také u pacientů s Ph+ CML‑CP s mutací T315I. Představuje tak léčebnou možnost pro pacienty, u kterých se po dvou předchozích terapiích TKI vyskytla rezistence a/nebo intolerance. Je studován v různých liniích léčby Ph+ CML‑CP, a to jak v monoterapii, tak v kombinaci. Přípravku Scemblix udělil úřad FDA status Breakthrough Therapy Designation.