Atogepant – důvod, proč hovořit o migréně

U málokterého onemocnění dochází k tak rychlému vývoji léčebných možností, jako je tomu u migrény. První léčivý přípravek pro preventivní a účinnou léčbu migrény cílený na calcitonin gene related peptid (CGRP) byl schválen Evropskou lékovou agenturou před více než šesti lety (v červenci 2018). Po čtyřech monoklonálních protilátkách se zaměřením proti CGRP přichází další skupina účinných preventivních léků – perorální gepanty. Zatím posledním zástupcem této lékové skupiny je atogepant.
„Podle výzkumu je prevalence migrény v populaci zhruba 12 procent, přitom stále roste. Migréna nejčastěji postihuje pacienty mezi 35. a 40. rokem věku. Podle Global Burden of Disease Study migréna jednoznačně patří mezi nejvíce invalidizující onemocnění, byla druhou nejvíce invalidizující diagnózou v roce 2019,“ shrnul základní fakta o migréně MUDr. Tomáš Nežádal, Ph.D., předseda Czech Headache Society, Sekce pro diagnostiku a léčbu bolesti hlavy České neurologické společnosti ČLS JEP, na kulatém stole Překážky v cestě pacienta s migrénou zdravotním systémem ČR, který se konal v červnu 2024 v prostorách Poslanecké sněmovny Parlamentu ČR (Medical Tribune 1. 7. 2024).
Historie léčby migrény
Pravděpodobně nejstarší dochovaný záznam o léčbě migrény obsahuje sumerská destička z doby mezi čtyřmi až třemi tisíci lety před naším letopočtem. Migrénu se údajně snažili léčit staří Egypťané (1200 př. n. l.). Detailně popsal migrénu se zrakovou aurou Hippokrates (kolem roku 400 př. n. l.). Termín migréna asi pochází ze slova hemikranie, jehož autorství je přisuzováno Galénovi (kolem roku 200) [1].
Rokem 1918 začíná ergotaminová éra. Tehdy Arthur Stoll izoloval první čistý námelový alkaloid – ergotamin, který se nejdříve používal v gynekologii. V roce 1925 Ernst Rothlin použil ergotamin tartarát v subkutánní injekci v léčbě těžké rezistentní migrény. Úspěšně. Ergotamin se pak používal v akutní léčbě migrény po desetiletí.
Calcitonin gene related peptid (CGRP), který byl identifikován jako klíčový faktor v rozvoji migrenózního záchvatu, byl objeven již v 80. letech 20. století, ale k jeho praktickému využití došlo až o 30 let později.
Od roku 1993 jsou k dispozici specifická akutní antimigrenika – triptany. Jejich nadměrné podávání může vést k sekundárně navozené bolesti hlavy z nadužívání léčby [2].
První studie s malými molekulami inhibujícími CGRP – gepanty (olcegepant a telcagepant) byly prováděny po roce 2000, ale pro hepatotoxicitu a nízkou biologickou dostupnost po perorálním podání byly ukončeny (2010).
Od roku 2018 se začínají používat monoklonální protilátky jako preventivní léčba, která je zaměřena buď proti receptoru pro CGRP, nebo proti ligandu CGRP. V současnosti jsou k dispozici již čtyři profylaktické monoklonální protilátky. Kromě specifické léčby se po léta používají v prevenci s ne zcela přesvědčivým efektem antikonvulziva, betablokátory, blokátory kalciových kanálů, antidepresiva a další – podrobně je léčba rozebrána na stránkách Czech Headache Society.
Nejnovější léčebnou modalitou jsou gepanty druhé a třetí generace.
Léčba akutní a profylaktická
V léčbě akutního migrenózního záchvatu se používají již zmíněné triptany, ale lze použít i jiná analgetika, nesteroidní antiflogistika a další. Tyto léčebné možnosti jsou však zatíženy rizikem indukce bolestí hlavy z nadužívání (medication overuse headache, MOH) a s postupným vyhasínáním účinnosti.
Profylaktická farmakoterapie migrény je indikována u pacientů se čtyřmi a více dny v měsíci s migrénou (MMD), se středně těžkými až těžkými atakami nebo u méně těžkých atak s těžkými neurologickými příznaky (například hemiplegická migréna), u pacientů s vysokým rizikem MOH nebo již s MOH a u pacientů, u nichž je akutní léčba neúčinná, netolerována nebo kontraindikována. Moderní anti‑CGRP přípravky jsou indikovány po selhání dvou linií standardních profylaktických léků, z nichž alespoň jedna musí být ze skupiny antikonvulziv.
Atogepant se představuje
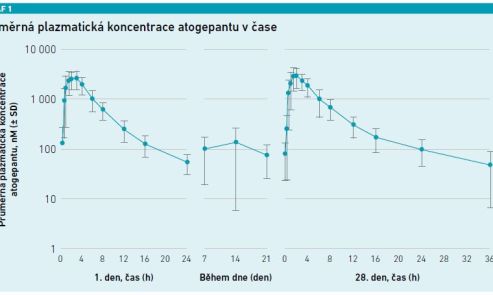 Atogepant je silný selektivní perorální antagonista receptoru pro CGRP. Váže se na N‑terminální domény RAMP1 a CLR, blokuje vazbu CGRP na jeho receptor a zabraňuje aktivaci tohoto receptoru (viz graf 1).
Atogepant je silný selektivní perorální antagonista receptoru pro CGRP. Váže se na N‑terminální domény RAMP1 a CLR, blokuje vazbu CGRP na jeho receptor a zabraňuje aktivaci tohoto receptoru (viz graf 1).
Účinnost profylaktické léčby – studie ADVANCE
V profylaktické léčbě epizodické migrény (EM) byl atogepant podávaný jedenkrát denně hodnocen v randomizované, placebem kontrolované studii fáze III ADVANCE. Primárním sledovaným parametrem byla změna průměrného MMD oproti vstupní hodnotě během 12 týdnů léčby. Sekundární cílové ukazatele zahrnovaly dny bolesti hlavy za měsíc, snížení tříměsíčního průměru MMD oproti výchozí hodnotě alespoň o 50 procent, kvalitu života a skóre zhoršení aktivity v deníku migrény (AIM‑D).
Do studie (analýzy účinnosti) bylo zařazeno 873 pacientů, kteří byli randomizováni k léčbě atogepantem v dávce 10 mg denně (n = 214), k dávce 30 mg (n = 223), k dávce 60 mg (n = 222) a k placebu (n = 214). Průměrný MMD se na začátku studie pohyboval od 7,5 do 7,9. Změny oproti výchozí hodnotě během 12 týdnů byly –3,7 dne (55,6 %) u 10 mg atogepantu, –3,9 dne (58,7 %) u 30 mg atogepantu, –4,2 dne (60,8 %) u 60 mg atogepantu a –2,5 dne (29,0 %) u placeba. Všechny rozdíly aktivně léčených skupin vůči placebu byly statisticky významné (p < 0,001).
Výsledky pro sekundární cíle byly superiorní a statisticky významné pro atogepant vs. placebo s výjimkou skóre AIM‑D Performance of Daily Activities a skóre AIM‑D Physical Impairment pro dávku 10 mg atogepantu. Nejčastějšími nežádoucími účinky byly zácpa (6,9–7,7 %) a nauzea (4,4–6,1 %) u všech dávek atogepantu.
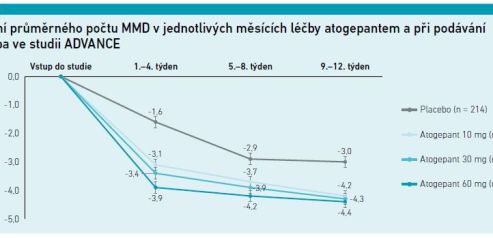 Časné a trvalé snížení počtu MMD bylo patrné již od prvního dne po zahájení léčby. Zajímavým zjištěním studie ADVANCE je zvyšující se podíl pacientů s nejméně 75% snížením počtu MMD a s dosažením nulového počtu MMD s prodlužující se délkou léčby atogepantem [3] (viz graf 2).
Časné a trvalé snížení počtu MMD bylo patrné již od prvního dne po zahájení léčby. Zajímavým zjištěním studie ADVANCE je zvyšující se podíl pacientů s nejméně 75% snížením počtu MMD a s dosažením nulového počtu MMD s prodlužující se délkou léčby atogepantem [3] (viz graf 2).
Dlouhodobá účinnost u EM
Účinnost a bezpečnost atogepantu u EM byly také hodnoceny v 52týdenní randomizované, otevřené studii fáze III. Ve studii bylo randomizováno 744 účastníků k atogepantu 60 mg (n = 546) nebo ke standardní perorální léčbě (n = 198). Průměrná změna MMD u atogepantu byla –3,8 (± 0,1) v týdnech 1–4 a –5,2 (± 0,2) v týdnech 49–52. Podobně se zvýšil podíl účastníků s ≥ 50% snížením MMD z 60,4 procenta v 1.–4. týdnu na 84,2 procenta v týdnech 49–52, s ≥ 75% snížením MMD z 37,2 procenta na 69,9 procenta a se 100% snížením MMD z 20,7 procenta na 48,4 procenta. To znamená, že po roce léčby atogepantem byla téměř polovina pacientů bez migrenózních atak.
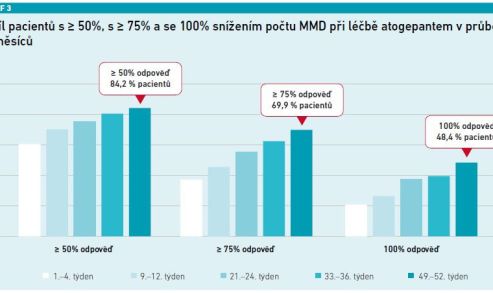 Nejčastěji hlášenými nežádoucími účinky (≥ 5 %) byly infekce horních cest dýchacích (10,3 %), zácpa (7,2 %), nauzea (6,3 %) a infekce močových cest (5,2 %). Závažné nežádoucí účinky byly hlášeny u 4,4 procenta pacientů léčených atogepantem. Denní užívání perorálního atogepantu 60 mg k preventivní léčbě migrény během této jednoleté otevřené studie bylo bezpečné, dobře tolerované a účinné [4] (viz graf 3).
Nejčastěji hlášenými nežádoucími účinky (≥ 5 %) byly infekce horních cest dýchacích (10,3 %), zácpa (7,2 %), nauzea (6,3 %) a infekce močových cest (5,2 %). Závažné nežádoucí účinky byly hlášeny u 4,4 procenta pacientů léčených atogepantem. Denní užívání perorálního atogepantu 60 mg k preventivní léčbě migrény během této jednoleté otevřené studie bylo bezpečné, dobře tolerované a účinné [4] (viz graf 3).
Atogepant na 37. českém a slovenském neurologickém sjezdu
Společnost AbbVie uspořádala v rámci 37. českého a slovenského neurologického sjezdu, který se konal koncem listopadu 2024 v Ostravě, satelitní sympozium Aquipta – od studií k realitě. Sympozium moderoval MUDr. Tomáš Nežádal, Ph.D. Kromě něj vystoupili se svými zkušenostmi MUDr. Dana Čtrnáctá (Ústřední vojenská nemocnice, Praha), primářka MUDr. Jolana Marková, FEAN (Fakultní Thomayerova nemocnice, Praha), a primář MUDr. Lukáš Klečka (Městská nemocnice Ostrava).
Úvodem představil MUDr. Tomáš Nežádal charakteristiku atogepantu: jde o přípravek, který má stejné indikace jako všechny molekuly s anti‑CGRP působením u epizodické migrény, tedy alespoň čtyři MMD. Dávkování je jednoduché – tableta s 60 mg účinné látky jednou denně. Tablety mohou být užity s jídlem nebo nalačno. Za speciální populaci lze považovat nemocné s těžkým jaterním selháním, kdy se podávání atogepantu nedoporučuje. Nejsou informace o atogepantu v těhotenství a při kojení. Výhodou atogepantu je jeho farmakokinetický profil: krátký biologický poločas (11 hodin), proto nevyžaduje titraci dávky. Maximální sérové koncentrace je dosaženo po jedné až dvou hodinách po užití, pak dochází k lineárnímu poklesu, což je výhodou při nutnosti vysazení.
Nejčastějšími nežádoucími účinky ve studiích byly infekce horních cest dýchacích, jejichž četnost se nelišila od četnosti ve skupině s placebem. Dalšími nežádoucími účinky byly nauzea, obstipace, únava či spavost. Nebyla pozorována alterace hodnot jaterních enzymů.
Úhrada přípravku Aquipta byla stanovena 1. července 2024 s tím, že je hrazen pacientům se čtyřmi MMD a po selhání nejméně dvou profylaktik, z nichž jedno je antiepileptikum. Kontraindikací je pouze hypersenzitivita na léčebnou látku nebo kteroukoli pomocnou látku. Je však nutné dát pozor na interakce se silnými inhibitory CYP450 3A4, což představují v praxi především makrolidová antibiotika. Následně MUDr. Nežádal představil studii 302, která je pokračováním studií CGP‑MD‑01 (SYNOPSIS, studie fáze II/III USA, hodnocení účinnosti a bezpečnosti atogepantu v dávkách 10, 30 a 60 mg), jež přešla do otevřené fáze s atogepantem 60 mg a zahrnovala pacienty i z ČR. Výsledky byly publikovány v časopise Headache [4].
Atogepant v praxi
V dalším průběhu sympozia si odborníci vyměňovali zkušenosti s léčbou anti‑CGRP přípravky obecně, proč léčbu jimi ukončují (zhruba ve 30 %, z toho skoro polovina pro neúčinnost, 12 % pro nežádoucí účinky a necelá 3 % pro plánování gravidity). Převedení na jiný typ anti‑CGRP musí schválit revizní lékař zdravotní pojišťovny.
V diskusi se řešil postup u pacientů – účastníků ukončené studie, jakým mechanismem pokračovat v léčbě účinným atogepantem. Velice pozitivně byl atogepant hodnocen z hlediska jednoduchosti zahájení léčby. Atogepant nevyžaduje speciální aplikační podmínky ani podmínky skladování. Na rozdíl od monoklonálních protilátek není nutné řešit kanylaci pacienta, není nutné mít aplikační stacionář.
Z praktických zkušeností plyne, že rozhovor s pacientem o jeho preferencích zvyšuje adherenci k léčbě. Většinou lidé dávají přednost perorální léčbě, ale jiní volí z nejrůznějších důvodů parenterální aplikaci.
Řečníci se podělili s kolegy o několik kazuistik, z nichž vyplynula dobrá účinnost a bezpečnost atogepantu u pacientů s EM. Jednotlivé případy si byly velmi podobné: vesměs šlo o pacientku kolem 40–50 let s migrénou s aurou či bez aury s trváním onemocnění kolem 10–15 let s MMD 7–14. V anamnéze měly zpravidla tři až pět typů profylaktických léků, léčbu triptany (jednou gabapentinem!!!), jedna pacientka na své náklady absolvovala léčbu onabotulotoxinem A. V počátcích měla standardní profylaktika alespoň částečný efekt, který po měsících vymizel, převážily nežádoucí účinky a dostavil se návrat často zhoršených a častějších atak migrény. V mnoha případech selhala i biologická léčba (jedenkrát těžká alergická reakce). Pro neúspěch léčby předchozích linií byla zahájena léčba atogepantem (ve studii i reálné praxi). Současné zkušenosti svědčí pro vysokou účinnost a snášenlivost atogepantu, který vedl k razantnímu snížení MMD (0–1 ataka za měsíc).
Literatura
Mastík J. Migréna – nová mezinárodní klasifikace a moderní léčebné postupy. Neurol. pro Praxi. 2004;5(2):79–83.
Migaľová P. Biologická léčba migrény. Med. Praxi. 2023;20(3):135–140.
Ailani J, Lipton RB, Goadsby PJ, et al.; ADVANCE Study Group. Atogepant for the Preventive Treatment of Migraine. N Engl J Med. 2021;385(8):695–706.
Ashina M, Tepper SJ, Reuter U, et al. Once‑daily oral atogepant for the long‑term preventive treatment of migraine: Findings from a multicenter, randomized, open‑label, phase 3 trial. Headache. 2023;63(1):79–88.