Hořčík (magnesium, magnezium, Mg2+) byl označován jako „zapomenutý elektrolyt“ a jeho klinický význam byl dlouho podceňován. Příčiny zjevného nedocenění klinického významu hořčíku mohou přinejmenším částečně spočívat v nedostatku informací o regulačních procesech tohoto kationtu na buněčné, tkáňové a systémové úrovni. Důležitost hořčíku v klinické medicíně byla uznána až nedávno, v reakci na výzvy odborníků. Pokrok v objevování kanálů a transportérů specifických pro hořčík přispěl k lepšímu pochopení jeho role v organismu. Tento přehled se zaměřuje na hypomagnezemii jako klinicky významnou poruchu hořčíku; hypermagnezemie je vzácná a obvykle se vyskytuje u pacientů s onemocněním ledvin.
Mg2+ je životně důležitý pro funkci a zdraví buněk, nachází se ve všech organismech a je klíčovým kofaktorem adenosintrifosfátu (ATP), buněčného zdroje energie. Podílí se na zásadních buněčných a fyziologických procesech, včetně vazby nukleotidů a regulace enzymatické aktivity. Všechny ATPázové reakce vyžadují komplex Mg2+ s ATP, což je nezbytné pro funkce RNA a DNA. Hořčík ovlivňuje metabolismus glukózy, lipidů a bílkovin, řídí nervosvalové funkce, srdeční rytmus a reguluje cévní tonus a sekreci hormonů. Dále hraje roli v centrálním nervovém systému jako modulátor N-methyl-D-aspartátu a je zapojen do nitrobuněčné signalizace a regulace cirkadiánního rytmu.
Vzhledem k zásadnímu významu hořčíku pro regulaci buněčných funkcí a signalizace je třeba přísně kontrolovat jeho intracelulární hladinu. Transportéry specifické pro hořčík byly identifikovány v 50. letech 20. století u bakterií, hub a kvasinek. Teprve o 50 let později byly identifikovány hořčíkové selektivní transportéry jako strážci homeostázy hořčíku u člověka. Mezi prvními to byly kationtové kanály přechodného receptorového potenciálu melastaninového typu TRPM6 a TRPM7. TRPM6 je exprimován především v tlustém střevě a distálním stočeném tubulu ledvin a je zodpovědný za reabsorpci hořčíku ve střevě a ledvinách. Klinický význam TRPM6 byl poprvé rozpoznán, když byly mutace TRPM6 spojeny s hypomagnezemií a sekundární hypokalcemií, jakož i s dalšími syndromy spojenými s hypomagnezemií. Řada faktorů ovlivňujících aktivitu TRPM6 a TRPM7 byla popsána jako magneziotropní (zahrnující regulaci hořčíku). Jedná se např. o epidermální růstový faktor (EGF), fibroblastový růstový faktor 23 (FGF23), aldosteron, angiotenzin II, bradykinin a inzulin. Mezi další transportéry hořčíku patří členové rodiny 41 transportérů solutů 1, 2 a 3, mediátory transportu kationtů dvojmocných kovů s doménou CBS 1 až 4 (CNNM1 až CNNM4) a hořčíkový selektivní mitochondriální RNA splicing protein 2 (MRS2). MAGT1, původně popsaný jako transportér hořčíku, je facilitátorem N-vázané glykosylace proteinů, který nepřímo ovlivňuje transport a homeostázu hořčíku.
Rovnováha hořčíku
Organismus obsahuje přibližně 25 g hořčíku, většinou uloženého v kostech a měkkých tkáních, kde je hlavně vázán na ligandy jako ATP a proteiny. Intracelulární volný hořčík činí pouze 1–5 % a jeho koncentrace je podobná koncentraci v extracelulární tekutině. V plazmě je 30 % cirkulujícího hořčíku vázáno na proteiny, a to převážně prostřednictvím volných mastných kyselin. Změny koncentrací volných mastných kyselin, EGF, inzulinu a aldosteronu mohou přispět k variabilitě hladin hořčíku v krvi, což souvisí s rizikem kardiovaskulárních onemocnění. Regulaci hořčíku zajišťují střeva (vstřebávání), kosti (ukládání) a ledviny (vylučování), které tvoří integrovaný systém pro jeho příjem, výměnu a vylučování. Poruchy v tomto systému mohou mít významné zdravotní důsledky.
Osa střevo-kost-ledviny a homeostáza
Mezi bohaté zdroje hořčíku v potravě patří obiloviny, fazole, ořechy a zelená zelenina (hořčík je základem chlorofylu). Z celkového množství hořčíku zkonzumovaného ve stravě se 30–40 % vstřebává ve střevě, a to zejména v tenkém střevě prostřednictvím paracelulárního transportu. V tlustém střevě dochází k jemnému vyladění vstřebávání hořčíku prostřednictvím transcelulárních mechanismů, na nichž se podílejí TRPM6 a TRPM7. Genetická inaktivace střevního TRPM7 způsobuje závažný nedostatek hořčíku, zinku a vápníku a je neslučitelná s časným postnatálním růstem a přežitím. Střevní absorpce hořčíku je ovlivněna faktory, jako je hořčík v potravě, pH střevního lumen, hormony (estrogen, inzulin, EGF, FGF23, parathormon) a střevní mikrobiota. V ledvinách je reabsorpce hořčíku nefrony umožněna paracelulárními a transcelulárními cestami. Na rozdíl od většiny iontů se asi pouze 20 % hořčíku reabsorbuje v proximálním tubulu, zatímco více než 70 % se vstřebává v tlustém vzestupném raménku Henleovy kličky. V distálním stočeném tubulu je jemné vyladění transcelulární reabsorpce hořčíku zprostředkováno apikálními TRPM6 a TRPM7, které determinují finální vylučování hořčíku močí.
Hořčík je hlavní složkou kostí; je v nich uloženo 60 % celkového množství hořčíku v těle. Výměnný hořčík v kostech představuje dynamickou zásobárnu, která udržuje fyziologické koncentrace v plazmě. Přispívá také k biologickému procesu tvorby kostí ovlivňováním aktivace osteoblastů a osteoklastů. Vysoký příjem hořčíku vede ke zvýšení obsahu kostních minerálů, což je důležité pro snížení rizika zlomenin kostí a osteoporózy během stárnutí. Hořčík má při obnově kostí dvojfázový účinek. Během akutních fází zánětu hořčík podporuje zvýšenou expresi TRPM7 v makrofázích, produkci cytokinů závislých na hořčíku a proosteogenní imunitní mikroprostředí. V pozdějších remodelačních fázích kostního hojení hořčík ovlivňuje osteogenezi a potlačuje precipitaci hydroxyapatitu. TRPM7 a hořčík se také podílejí na kalcifikaci cév tím, že ovlivňují fenotypové přepínání buněk hladké svaloviny cév na osteogenní fenotyp.
Hypomagnezemie
Hypomagnezemie je stav, kdy hladina sérového hořčíku klesá pod 1,7 mg/dl, přičemž normální hodnoty se pohybují v rozmezí od 1,7 do 2,4 mg/dl. Většina pacientů s hraniční hypomagnezemií je asymptomatická. Vzhledem k tomu, že u pacientů se může projevovat chronický latentní deficit hořčíku při hladinách sérového hořčíku nad 1,5 mg/dl (0,6 mmol/l), bylo navrženo zvýšit dolní hranici definující hypomagnezemii. Tato hodnota je však kontroverzní a vyžaduje další klinické ověření.
Prevalence hypomagnezemie se pohybuje v rozmezí 3–10 % v běžné populaci, ale stoupá například u pacientů s diabetem 2. typu a u pacientů na intenzivní péči, kde přesahuje 65 %. K hypomagnezemii může vést nedostatek příjmu, zvýšené ztráty v trávicím traktu, snížená reabsorpce v ledvinách nebo redistribuce hořčíku. Pacienti často vykazují nespecifické příznaky, jako jsou letargie, svalové křeče a slabost. Tento stav je obvykle spojen s dalšími poruchami rovnováhy elektrolytů, což může vést k přehlédnutí hypomagnezemie, jelikož hladina sérového hořčíku není běžně měřena. V těžkých případech se mohou objevit závažné neurologické a kardiovaskulární symptomy. Je důležité si uvědomit, že méně než 1 % hořčíku v těle se nachází v plazmě, což znamená, že plazmatické koncentrace nejsou spolehlivým ukazatelem celkového obsahu hořčíku ve tkáních. Zhodnocení nedostatku hořčíku pouze na základě sérových hladin může v klinické praxi podceňovat skutečný deficit hořčíku.
U pacientů s hypomagnezemií se běžně vyskytuje i hypokalemie, kterou často nelze korigovat bez normalizace hodnot hořčíku. Nedostatek hořčíku zvyšuje renální ztráty draslíku aktivací sekrece v ledvinných kanálech. Snížená hladina hořčíku inhibuje Na+-K+-ATPázovou pumpu a zvyšuje ztráty draslíku, což také ovlivňuje aktivaci Na+-Cl- kotransportéru (NCC) zajišťující reabsorpci sodíku. Dlouhodobé snížení aktivace NCC podporuje hypokalemii a hypokalcemii. Hypoparatyreóza způsobená hypomagnezemií snižuje uvolňování parathormonu a citlivost ledvin na parathormon, což vede k poklesu reabsorpce vápníku. Hypokalcemie je z tohoto důvodu refrakterní na korekci, dokud se hodnota hořčíku nezlepší.
Léky indukovaná hypomagnezemie
Úbytek hořčíku a hypomagnezemii může navozovat mnoho léků, včetně antibiotik, diuretik, biologických přípravků, imunosupresiv, inhibitorů protonové pumpy (PPI) a chemoterapeutik. Dlouhodobé užívání PPI vede k nedostatku hořčíku přibližně u 20 % pacientů, přičemž účinky jsou závislé na dávce. PPI snižují vstřebávání hořčíku ve střevech a jsou spojeny se změnami v luminálním pH a střevní mikrobiotě. Většina případů hypomagnezemie vyvolané léky se vysvětluje renální ztrátou hořčíku. Inhibitory kalcineurinu, cisplatina, antagonisté receptoru EGF (např. cetuximab a erlotinib) a inhibitory mTOR (mammalian target of rapamycin) způsobují hypomagnezemii u 20 až 40 % pacientů, přičemž hlavním mechanismem je snížená aktivita TRPM6 a TRPM7 v distálním stočeném tubulu.
Další příčiny hypomagnezemie
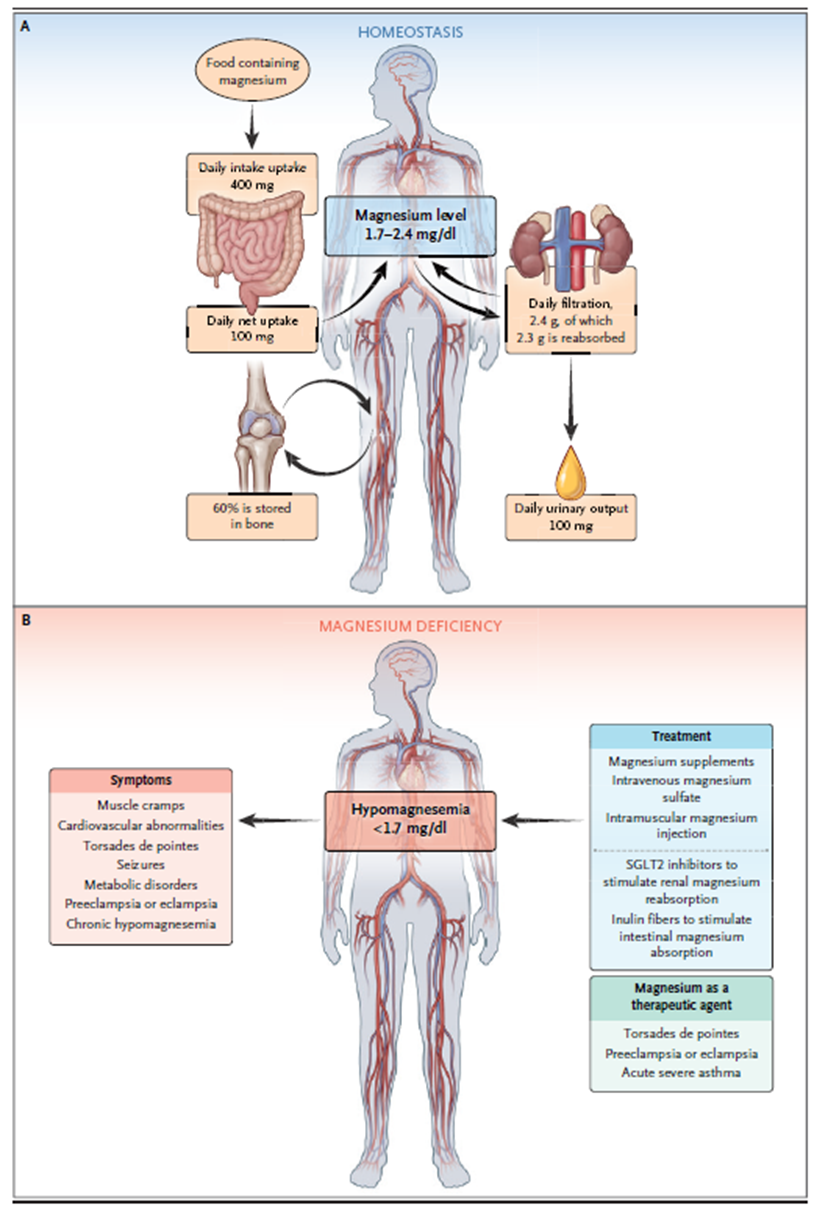 Hypomagnezemie je nejčastější elektrolytovou abnormalitou spojenou s chronickým užíváním alkoholu, přičemž hlavními mechanismy jsou snížený příjem hořčíku, zvýšené gastrointestinální ztráty a magnesurie způsobená poškozením renálních tubulů alkoholem. Tento stav souvisí s jaterní dysfunkcí a s horší prognózou onemocnění jater. Hypomagnezemie je také běžně pozorována u pacientů s diabetem 2. typu, kde je pravděpodobně způsobena renálním úbytkem hořčíku a inzulinovou rezistencí. Hypomagnezemie ovlivňuje i kardiovaskulární systém, zvyšuje riziko arytmií a zhoršuje endoteliální dysfunkci. U těhotenských hypertenzních onemocnění, jako jsou preeklampsie a eklampsie, mohou být hodnoty hořčíku normální nebo snížené, přičemž intravenózní léčba hořčíkem může zmírnit komplikace. Nově identifikované autoprotilátky proti klaudinu 16 naznačují, že příčinou hypomagnezemie může být také autoimunita. Dědičná hypomagnezemie je převážně způsobena genetickými variantami ovlivňujícími transport hořčíku, přičemž asi 80 % pacientů vykazuje genetické příčiny. Nejčastěji jsou postiženy mechanismy reabsorpce hořčíku v distálním stočeném tubulu, přičemž mutace v podjednotkách TRPM6 a TRPM7 vedou k hypokalcemii. Hypokalcemie u těchto pacientů se vysvětluje hypoparatyreózou způsobenou nízkou intracelulární hladinou hořčíku v příštítných tělískách, která narušuje sekreci parathormonu. Metabolismus hořčíku dále ovlivňují varianty v genech EGF a EGFR. Gitelmanův syndrom, charakterizovaný hypomagnezemií a hypokalemií, je spojen s mutacemi v NCC a s atrofií tubulů, což zhoršuje reabsorpci hořčíku. Další mutace v mitochondriálních tRNA a genech KCNJ10, CLCNKB a CLDN16/CLDN19 souvisejí s podobnými fenotypy poruchy metabolismu hořčíku. Patogenní varianty v genu RRAGD byly identifikovány jako příčina tubulopatie ledvin, která připomíná fenotyp familiární hypomagnezemie s hyperkalciurií a nefrokalcinózou kombinovanou s dilatační kardiomyopatií.
Hypomagnezemie je nejčastější elektrolytovou abnormalitou spojenou s chronickým užíváním alkoholu, přičemž hlavními mechanismy jsou snížený příjem hořčíku, zvýšené gastrointestinální ztráty a magnesurie způsobená poškozením renálních tubulů alkoholem. Tento stav souvisí s jaterní dysfunkcí a s horší prognózou onemocnění jater. Hypomagnezemie je také běžně pozorována u pacientů s diabetem 2. typu, kde je pravděpodobně způsobena renálním úbytkem hořčíku a inzulinovou rezistencí. Hypomagnezemie ovlivňuje i kardiovaskulární systém, zvyšuje riziko arytmií a zhoršuje endoteliální dysfunkci. U těhotenských hypertenzních onemocnění, jako jsou preeklampsie a eklampsie, mohou být hodnoty hořčíku normální nebo snížené, přičemž intravenózní léčba hořčíkem může zmírnit komplikace. Nově identifikované autoprotilátky proti klaudinu 16 naznačují, že příčinou hypomagnezemie může být také autoimunita. Dědičná hypomagnezemie je převážně způsobena genetickými variantami ovlivňujícími transport hořčíku, přičemž asi 80 % pacientů vykazuje genetické příčiny. Nejčastěji jsou postiženy mechanismy reabsorpce hořčíku v distálním stočeném tubulu, přičemž mutace v podjednotkách TRPM6 a TRPM7 vedou k hypokalcemii. Hypokalcemie u těchto pacientů se vysvětluje hypoparatyreózou způsobenou nízkou intracelulární hladinou hořčíku v příštítných tělískách, která narušuje sekreci parathormonu. Metabolismus hořčíku dále ovlivňují varianty v genech EGF a EGFR. Gitelmanův syndrom, charakterizovaný hypomagnezemií a hypokalemií, je spojen s mutacemi v NCC a s atrofií tubulů, což zhoršuje reabsorpci hořčíku. Další mutace v mitochondriálních tRNA a genech KCNJ10, CLCNKB a CLDN16/CLDN19 souvisejí s podobnými fenotypy poruchy metabolismu hořčíku. Patogenní varianty v genu RRAGD byly identifikovány jako příčina tubulopatie ledvin, která připomíná fenotyp familiární hypomagnezemie s hyperkalciurií a nefrokalcinózou kombinovanou s dilatační kardiomyopatií.
Hodnocení hypomagnezemie v klinické praxi
Standardní klinickou metodou pro posouzení stavu hořčíku je měření celkového hořčíku v séru, které umožňuje rychlé vyhodnocení krátkodobých změn, ale může podhodnocovat celkový obsah hořčíku v organismu. Výsledky mohou být ovlivněny endogenními faktory (např. hypoalbuminemie) a exogenními faktory (např. hemolýza vzorků, antikoagulancia-EDTA v odběrových zkumavkách). Měření ionizovaného hořčíku je také možné, ale jeho klinická využitelnost je sporná. Při diagnostice hypomagnezemie bývá příčina obvykle zřejmá z anamnézy pacienta, ale pokud tomu tak není, je důležité rozlišit mezi renálními a gastrointestinálními ztrátami hořčíku pomocí specifických diagnostických metod.
Suplementace hořčíku
Suplementace hořčíku je základem pro zvládnutí hypomagnezemie, přesto ale neexistují jasná doporučení pro její léčbu; přístupy tedy do značné míry závisejí na závažnosti klinických projevů. Mírnou hypomagnezemii lze korigovat perorálními doplňky. K dispozici je mnoho přípravků s hořčíkem s různou mírou vstřebávání. Lépe se vstřebávají organické soli (citrát hořečnatý, aspartát, glycinát, glukonát a laktát) než anorganické soli (chlorid hořečnatý, uhličitan a oxid). Častým vedlejším účinkem perorální suplementace hořčíku je průjem, který představuje problém při perorální substituci. V rezistentních případech může být nutná adjuvantní farmakoterapie. Farmakologická inhibice epiteliálního sodíkového kanálu amiloridem nebo triamterenem u pacientů s normální funkcí ledvin zvyšuje hladiny hořčíku v séru. Mezi další možné strategie patří inhibitory sodíko-glukózového kotransportéru typu 2, které zvyšují hladinu hořčíku v séru, zejména u pacientů s diabetem. Mechanismy, které jsou základem těchto účinků, nejsou jasné, ale důležitá může být snížená glomerulární filtrace a zvýšená renální tubulární reabsorpce. Parenterální léčba je indikována u pacientů, jejichž hypomagnezemie je refrakterní na perorální léčbu, jako jsou pacienti se syndromem krátkého střeva, pacienti s tetanií nebo záchvaty a pacienti, jejichž stav je hemodynamicky nestabilní s arytmiemi nebo s přidruženou hypokalemií a hypokalcemií. Hypomagnezemie vyvolaná PPI příznivě reaguje na perorální inulin prostřednictvím mechanismů, které mohou zahrnovat změny střevní mikrobioty.
Hořčík jako léčivo
Hořčík je lékem volby pouze u několika onemocnění, jako jsou torsades de pointes, akutní exacerbace astmatu a preeklampsie či eklampsie. U pacientů s torsades de pointes, kteří nereagují na betablokátory, je doporučeno podávat hořčík. U závažných exacerbací astmatu, které nereagují na intenzivní počáteční léčbu, a u pacientů s život ohrožujícím astmatem je doporučeno intravenózní podání síranu hořečnatého. Přidání nebulizovaného síranu hořečnatého k inhalačním β2-agonistům a ipratropiu může zlepšit funkci plic a zkrátit dobu hospitalizace. Příznivé účinky hořčíku u astmatu pravděpodobně souvisejí s blokádou vápníkových kanálů v hladkých svalech bronchů, což vede k bronchodilataci. U žen s eklampsií se má podávat síran hořečnatý, aby se předešlo záchvatům, a u preeklampsie s vážnými příznaky je také doporučena léčba síranem hořečnatým. Mechanismy účinku hořčíku však nejsou detailně objasněny.
Závěry
Hořčík je v klinické medicíně klíčovým elektrolytem, přesto se na něj při běžných vyšetřeních často zapomíná. Hypomagnezemie, která je často asymptomatická, byla lépe pochopena díky pokroku v genovém screeningu a sekvenování celého exomu, což odhalilo nové geny spojené s dědičnými formami tohoto onemocnění. Hypomagnezemii mohou vyvolat různé léky a užívání alkoholu, je také často přítomna u diabetiků 2. typu a u pacientů s autoimunitními chorobami. Základem pro zvládnutí hypomagnezemie je suplementace hořčíku, ideálně ve formě organických solí. Nad hořčíkem a jeho regulací ve zdraví a nemoci visí stále mnoho otazníků, přesto by se ale tomuto „zapomenutému a znovu objevenému“ elektrolytu měla v klinické praxi věnovat větší pozornost.
Reference
Touyz RM, et al. Magnesium Disorders. N Engl J Med 2024;390:1998–2009. DOI: 10.1056/NEJMra1510603
 Hypomagnezemie je nejčastější elektrolytovou abnormalitou spojenou s chronickým užíváním alkoholu, přičemž hlavními mechanismy jsou snížený příjem hořčíku, zvýšené gastrointestinální ztráty a magnesurie způsobená poškozením renálních tubulů alkoholem. Tento stav souvisí s jaterní dysfunkcí a s horší prognózou onemocnění jater. Hypomagnezemie je také běžně pozorována u pacientů s diabetem 2. typu, kde je pravděpodobně způsobena renálním úbytkem hořčíku a inzulinovou rezistencí. Hypomagnezemie ovlivňuje i kardiovaskulární systém, zvyšuje riziko arytmií a zhoršuje endoteliální dysfunkci. U těhotenských hypertenzních onemocnění, jako jsou preeklampsie a eklampsie, mohou být hodnoty hořčíku normální nebo snížené, přičemž intravenózní léčba hořčíkem může zmírnit komplikace. Nově identifikované autoprotilátky proti klaudinu 16 naznačují, že příčinou hypomagnezemie může být také autoimunita. Dědičná hypomagnezemie je převážně způsobena genetickými variantami ovlivňujícími transport hořčíku, přičemž asi 80 % pacientů vykazuje genetické příčiny. Nejčastěji jsou postiženy mechanismy reabsorpce hořčíku v distálním stočeném tubulu, přičemž mutace v podjednotkách TRPM6 a TRPM7 vedou k hypokalcemii. Hypokalcemie u těchto pacientů se vysvětluje hypoparatyreózou způsobenou nízkou intracelulární hladinou hořčíku v příštítných tělískách, která narušuje sekreci parathormonu. Metabolismus hořčíku dále ovlivňují varianty v genech EGF a EGFR. Gitelmanův syndrom, charakterizovaný hypomagnezemií a hypokalemií, je spojen s mutacemi v NCC a s atrofií tubulů, což zhoršuje reabsorpci hořčíku. Další mutace v mitochondriálních tRNA a genech KCNJ10, CLCNKB a CLDN16/CLDN19 souvisejí s podobnými fenotypy poruchy metabolismu hořčíku. Patogenní varianty v genu RRAGD byly identifikovány jako příčina tubulopatie ledvin, která připomíná fenotyp familiární hypomagnezemie s hyperkalciurií a nefrokalcinózou kombinovanou s dilatační kardiomyopatií.
Hypomagnezemie je nejčastější elektrolytovou abnormalitou spojenou s chronickým užíváním alkoholu, přičemž hlavními mechanismy jsou snížený příjem hořčíku, zvýšené gastrointestinální ztráty a magnesurie způsobená poškozením renálních tubulů alkoholem. Tento stav souvisí s jaterní dysfunkcí a s horší prognózou onemocnění jater. Hypomagnezemie je také běžně pozorována u pacientů s diabetem 2. typu, kde je pravděpodobně způsobena renálním úbytkem hořčíku a inzulinovou rezistencí. Hypomagnezemie ovlivňuje i kardiovaskulární systém, zvyšuje riziko arytmií a zhoršuje endoteliální dysfunkci. U těhotenských hypertenzních onemocnění, jako jsou preeklampsie a eklampsie, mohou být hodnoty hořčíku normální nebo snížené, přičemž intravenózní léčba hořčíkem může zmírnit komplikace. Nově identifikované autoprotilátky proti klaudinu 16 naznačují, že příčinou hypomagnezemie může být také autoimunita. Dědičná hypomagnezemie je převážně způsobena genetickými variantami ovlivňujícími transport hořčíku, přičemž asi 80 % pacientů vykazuje genetické příčiny. Nejčastěji jsou postiženy mechanismy reabsorpce hořčíku v distálním stočeném tubulu, přičemž mutace v podjednotkách TRPM6 a TRPM7 vedou k hypokalcemii. Hypokalcemie u těchto pacientů se vysvětluje hypoparatyreózou způsobenou nízkou intracelulární hladinou hořčíku v příštítných tělískách, která narušuje sekreci parathormonu. Metabolismus hořčíku dále ovlivňují varianty v genech EGF a EGFR. Gitelmanův syndrom, charakterizovaný hypomagnezemií a hypokalemií, je spojen s mutacemi v NCC a s atrofií tubulů, což zhoršuje reabsorpci hořčíku. Další mutace v mitochondriálních tRNA a genech KCNJ10, CLCNKB a CLDN16/CLDN19 souvisejí s podobnými fenotypy poruchy metabolismu hořčíku. Patogenní varianty v genu RRAGD byly identifikovány jako příčina tubulopatie ledvin, která připomíná fenotyp familiární hypomagnezemie s hyperkalciurií a nefrokalcinózou kombinovanou s dilatační kardiomyopatií.