Nádorové buňky v polepšovně. Čeští autoři popsali nové přístupy k léčbě

V prestižním časopise Trends in Molecular Medicine recentně vyšel přehledový článek Mgr. Anety Škarkové, Ph.D., a jejích kolegů z laboratoře prof. RNDr. Jana Brábka, Ph.D., vedoucího skupiny Molekulární a buněčné mechanismy invazivity nádorových buněk Katedry buněčné biologie Přírodovědecké fakulty UK, BIOCEV a Národního ústavu pro výzkum rakoviny. Popisuje nové přístupy k léčbě onkologických onemocnění založené na jiných principech, než je zabránění proliferaci nádorových buněk.
Autoři úvodem připomínají, že tradiční cytotoxická léčba vystavuje nádorové buňky přímému zabíjení, což ale nahrává darwinovskému procesu přirozeného výběru, který upřednostňuje přežití rezistentních buněk – ať už se jedná o rezistenci „vrozenou“, nebo získanou. Tak vznikají subpopulace nádorových buněk odolávajících léčbě, jejichž počet postupně převýší původní populaci, což v konečném důsledku bohužel často vede k selhání terapie a recidivě nádoru.
Onkogenní vlastnosti buněk se však neomezují na pouhou proliferaci, ale zahrnují řadu dalších fenoménů, například fenotypovou plasticitu nebo invazivitu, na které se stávající terapie zaměřují jen okrajově. Získání kontroly nad těmito vlastnostmi prostřednictvím cíleného ovlivnění chování nádorových buněk tak představuje možnou strategii pro vývoj nových způsobů onkologické léčby do budoucna.
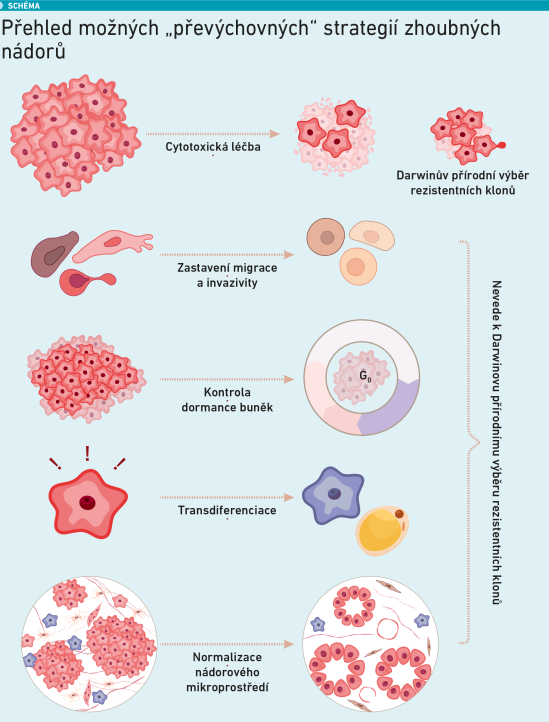
 Jinými slovy, namísto zabíjení by možná bylo často účelnější nádorové buňky převychovat k méně malignímu fenotypu, a tím obejít jejich nejsilnějšího spojence – přirozený výběr vytvářející rezistentní a vysoce přizpůsobivé klony. V článku jsou zmíněny hned čtyři potenciální strategie, jak toho dosáhnout – kontrola dormance buněk, transdiferenciační terapie, normalizace nádorového mikroprostředí a ovlivnění migrace. Každá z těchto „převýchovných“ strategií má při nalezení vhodných indikačních kritérií potenciál revolučně změnit léčbu onkologických onemocnění. A co víc – i pokud nádorové buňky vyvinou vůči těmto strategiím adaptivní rezistenci, nepřinese jim to přímou proliferační výhodu. Protože nerezistentní buňky nejsou touto léčbou eradikovány, nemají ty rezistentní šanci v nádoru tak snadno převládnout.
Jinými slovy, namísto zabíjení by možná bylo často účelnější nádorové buňky převychovat k méně malignímu fenotypu, a tím obejít jejich nejsilnějšího spojence – přirozený výběr vytvářející rezistentní a vysoce přizpůsobivé klony. V článku jsou zmíněny hned čtyři potenciální strategie, jak toho dosáhnout – kontrola dormance buněk, transdiferenciační terapie, normalizace nádorového mikroprostředí a ovlivnění migrace. Každá z těchto „převýchovných“ strategií má při nalezení vhodných indikačních kritérií potenciál revolučně změnit léčbu onkologických onemocnění. A co víc – i pokud nádorové buňky vyvinou vůči těmto strategiím adaptivní rezistenci, nepřinese jim to přímou proliferační výhodu. Protože nerezistentní buňky nejsou touto léčbou eradikovány, nemají ty rezistentní šanci v nádoru tak snadno převládnout.
Strategie 1: kontrola dormance buněk
Jak uvádějí autoři článku, fenomén dormance neboli klidu, který se vyznačuje dočasným a vratným zastavením růstu, je adaptivní strategií, kterou využívají všechny živé organismy, aby čelily nepříznivým a náročným podmínkám a zajistily si tak přežití. Nádorové buňky – ať už samy o sobě, nebo ve formě mikrometastáz – zastavené ve fázi G0 buněčného cyklu se vyhýbají imunitnímu systému a jsou rezervoárem genetické a epigenetické variability, která se pro ně stává výhodnou při náhlých změnách, jako je jejich vystavení cytotoxické terapii.
„Dříve byl vstup do fáze G0 buněčného cyklu považován za pouhou absenci proliferační signalizace. Nyní je zřejmé, že se jedná o aktivní a programovatelnou reakci, která může být iniciována různými podněty. Integrace různých signálů rozhoduje o tom, zda buňky proliferují, přecházejí do klidového stavu nebo se probouzejí z dormance. Doba trvání a povaha ‚proklidové‘ signalizace koreluje s hloubkou klidového stavu, která je pak spojena s metabolickým a epigenetickým přeprogramováním,“ píše se v článku.
Vzhledem k tomu, že schopnost nádorových buněk zahájit klidový program je jedním z klíčových mechanismů rezistence, může být kontrola klidového stavu buněk cenným terapeutickým přístupem. Obecně tento přístup zahrnuje tři strategie – lock-in (uzamčení), lock-out (odemčení) a přímé zabíjení.
„Strategie lock-in se zaměřuje na udržení reziduálních dormantních buněk nebo mikrometastáz v zástavě prostřednictvím inhibice drah jejich opětovného probuzení. Zřejmou nevýhodou je, že se nejedná o kurativní přístup a terapie by musela být podávána doživotně, což při množství nežádoucích účinků stávajících léků zatím není možné. Strategie lock-in by ale také mohla stimulovat trvalé zastavení buněčného cyklu a přechod do senescentního fenotypu, na který by se následně zaměřila senolytika,“ vysvětluje prof. Brábek.
Jak dále upřesňuje, strategie lock-out, tedy odemčení, naopak cílí na dráhy, které usnadňují přechod do klidového stavu anebo které klidový stav udržují. „V prvním případě by to znamenalo terapeuticky ovlivnit chování buňky vystavené konvenční protinádorové terapii – neumožnit jí vstoupit do klidového stavu a místo toho usnadnit spuštění apoptotického programu. Ve druhém případě by narušení udržování dormance vedlo k opětovnému probuzení nádorových buněk a jejich proliferaci, a tím i k opětovné senzibilizaci na protinádorovou léčbu,“ dodává J. Brábek.
Strategie 2: transdiferenciační terapie
Úvodem další části článku autoři připomínají, že přeprogramování nádorových buněk s využitím transkripčních faktorů nebo jejich transdiferenciace pomocí léku, který aktivitu požadovaných transkripčních faktorů ovlivňuje, je slibnou cestou v současném výzkumu léčby onkologických onemocnění. Platí to i pro metastatické nádorové buňky, jak bylo prokázáno u leukémií. Například transkripční faktor C/EBPα řídí přeměnu buněk B lymfoblastické leukémie na buňky podobné makrofágům, což snižuje jejich nádorovou aktivitu. V praxi se uplatňuje léčba akutní promyelocytární leukémie, při níž se terminální diferenciace leukemických promyelocytů ve zralé granulocyty rutinně dosahuje kombinací kyseliny all-trans-retinové s oxidem arsenitým. Tento terapeutický režim změnil kdysi fatální diagnózu v onemocnění, které je až v 80 procentech případů léčitelné.
 Jak podotýká prof. Brábek, pokrok byl zaznamenán i u solidních nádorů a jejich metastáz. Přeměna invazivních nádorových buněk karcinomu prsu, které prošly epiteliálně mezenchymální tranzicí, na adipocyty pomocí agonisty metabolických jaderných receptorů gama aktivovaných tzv. proliferátory peroxizomů (PPARγ) v kombinaci s inhibitorem MEK potlačila primární nádorovou invazi a tvorbu metastáz na myších modelech. Tyto adipocyty odvozené z transdiferencovaných nádorových buněk měly omezenou schopnost růstu a ztratily svou buněčnou plasticitu. „Výzkum epigenetického a metabolického přeprogramování zprostředkovaného transkripčními faktory naznačuje velký potenciál i u gliomu, karcinomu prostaty a hepatocelulárního karcinomu. Také tato strategie poukazuje na to, že řízení rakoviny namísto boje s ní může přinést dlouho hledané nové možnosti léčby,“ konstatuje J. Brábek.
Jak podotýká prof. Brábek, pokrok byl zaznamenán i u solidních nádorů a jejich metastáz. Přeměna invazivních nádorových buněk karcinomu prsu, které prošly epiteliálně mezenchymální tranzicí, na adipocyty pomocí agonisty metabolických jaderných receptorů gama aktivovaných tzv. proliferátory peroxizomů (PPARγ) v kombinaci s inhibitorem MEK potlačila primární nádorovou invazi a tvorbu metastáz na myších modelech. Tyto adipocyty odvozené z transdiferencovaných nádorových buněk měly omezenou schopnost růstu a ztratily svou buněčnou plasticitu. „Výzkum epigenetického a metabolického přeprogramování zprostředkovaného transkripčními faktory naznačuje velký potenciál i u gliomu, karcinomu prostaty a hepatocelulárního karcinomu. Také tato strategie poukazuje na to, že řízení rakoviny namísto boje s ní může přinést dlouho hledané nové možnosti léčby,“ konstatuje J. Brábek.
Strategie 3: normalizace mikroprostředí nádoru
Možnost reverze nádoru, tedy jeho přeměny na tkáň s normálními, nenádorovými vlastnostmi, je podle autorů článku další z hledaných terapeutických možností. Reverze nádoru lze v určitých případech účinně dosáhnout v návaznosti na rekonfiguraci cytoskeletu vyvolanou širokou škálou molekulárních a biofyzikálních faktorů, zejména pokud tyto modifikace zasáhnou komplexně interakce mezi nádorovými buňkami a nádorovým mikroprostředím. Snížení přísunu živin, změna pH a ovlivnění sekrece řady cytokinů, to vše může ovlivnit nádorové mikroprostředí natolik, že dojde k převýchově nádorových buněk do méně maligního fenotypu.
„Klíčovou roli ve vývoji nádorů, zejména metastáz, hraje epiteliálně mezenchymální tranzice (EMT). Opačný proces, tj. mezenchymálně epiteliální přechod (MET), je tedy nezbytným krokem k nastartování reverze migračního fenotypu. Klíčové aspekty procesu reverze EMT zahrnují remodelaci cytoskeletu a ovlivnění specifických molekulárních signálních uzlů. Mezi ovlivněné patří adhezní proteiny, jako jsou E-kadherin/β-katenin, translačně řízený nádorový protein (TCTP) a také presenilin a dráha PI3K/Akt,“ upozorňuje prof. Brábek.
Jak dále uvádí, prokázáno bylo, že mezenchymálně epiteliální tranzici podporuje myo-inositol, stereoizomer pseudovitaminu B8 inositolu, a to pleiotropní modulací několika intra- a extracelulárních cílů včetně TCTP, PI3K a p53, což vede ke zvratu EMT. „Posiluje spojení mezi buňkami obnovením vazby na bázi E-kadherinu a přispívá k normalizaci mikroprostředí i tím, že snižuje produkci metaloproteináz a inhibuje dráhy související s IP6K1, které jsou kritické jak pro cytoskelet, tak pro metabolické přeprogramování,“ dodává.
Četné experimentální studie prokázaly i to, že nádorové buňky mohou být pod kontrolou, pokud jsou vystaveny působení embryonálních extraktů z tkáně v raných stadiích diferenciace. Například vystavení nádorových buněk rybímu embryonálnímu extraktu inhibuje EMT a růst nádoru a zároveň podporuje reverzi nádoru prostřednictvím modulace TCTP. Podobné antiproliferativní a proapoptotické účinky v xenograftových modelech vykazují i exozomy odvozené z lidských embryonálních kmenových buněk. Předpokládá se, že tyto exozomy mohou do nádorových buněk přenášet určité faktory (některé dosud neidentifikované) vyvolávající podstatné zvýšení exprese některých genů, které se podílejí na fenotypové reverzi – konkrétně SOX2, OCT4 a Nanog – a které umožňují buněčné populaci znovu získat vyšší plasticitu. Je pravděpodobné, že obnovení totipotentního stavu umožňuje přesměrovat buňky k benignější diferenciaci. Tyto protinádorové účinky byly potvrzeny ve studiích in vivo i v randomizované klinické studii s prokazatelným zlepšením celkového přežití pacientů s pokročilým hepatocelulárním karcinomem po podání výtažků z rybích embryí.
Úprava složení a struktury nádorového mikroprostředí může vést za určitých okolností k reverzi prekancerózních lézí. Například u Barrettova jícnu bylo potažením metaplastické sliznice jícnu mukoadhezivním hydrogelem složeným z normálních složek extracelulární matrix dosaženo obnovy normálního stav epitelu.
„Další strategie normalizace nádorového mikroprostředí spočívá v cíleném působení na lysyloxidázu, enzym produkovaný nádorovými buňkami zodpovědný za vznik příčných vazeb mezi vlákny kolagenu, které přispívají k ‚tuhnutí‘ extracelulární matrix. Inhibice lysyloxidázy prokázala schopnost bránit tuhnutí matrix a následně snižovat metastatický potenciál u karcinomu pankreatu a zlepšit účinnost léčby nádorů v různých myších modelech,“ vysvětluje J. Brábek.
Uvedené výzkumy naznačují, že modulací nádorového mikroprostředí lze dosáhnout reverze tumoru a obnovy funkčních vztahů mezi buňkami, a tím včas zasáhnout do progrese nádoru.
Strategie 4: migrastatické léky
Většina nádorů v metastazujícím stadiu je při současné léčbě stále špatně léčitelná. Šíření metastáz přímo závisí na invazi nádorových buněk, která je charakteristickým znakem maligních buněk ve srovnání s benigními. Nádorové buňky si osvojily invazivní proces a vykazují pozoruhodný repertoár způsobů invaze, od kolektivní migrace celých buněčných vláken nebo plátů až po cestování jednotlivých oddělených buněk (v proteolyticky aktivním a na adhezi závislém mezenchymálním invazivním režimu nebo na proteázách nezávislém a vysoce dynamickém améboidním invazivním režimu). Léky zaměřené na invazi nádorů bez ohledu na specifické způsoby invaze, souhrnně označované jako migrastatika, představují nový komplementární terapeutický přístup, jehož cílem je bránit spíše nádorové invazi než nádorové proliferaci.
 „Protimigrační terapie by se měla v ideálním případě zaměřit na základní mechanismy společné všem způsobům nádorové invaze, aby se snížila pravděpodobnost adaptivních reakcí vedoucích k úniku před léčbou,“ zdůrazňuje prof. Brábek.
„Protimigrační terapie by se měla v ideálním případě zaměřit na základní mechanismy společné všem způsobům nádorové invaze, aby se snížila pravděpodobnost adaptivních reakcí vedoucích k úniku před léčbou,“ zdůrazňuje prof. Brábek.
Na rozdíl od cytotoxických léků nemají migrastatika za cíl zabíjet nádorové buňky, „pouze“ omezují jejich schopnost migrovat do dalších oblastí těla, což vyžaduje nový přístup k designu klinických studií a hodnocení účinnosti těchto léků. V této souvislosti je významné, že dobu přežití bez metastáz (metastasis-free survival, MFS) v roce 2018 schválil americký Úřad pro kontrolu potravin a léčiv (FDA) jako nový primární cíl klinických studií.
„Migrastatická léčiva nebyla dosud testována na pacientech, takže nejvhodnější přístup k jejich podávání lze pouze odhadovat na základě předpokládaných mechanismů jejich účinku. Stupeň pokročilosti nádorového onemocnění bude pravděpodobně nejkritičtějším kritériem při určování způsobu použití migrastatik,“ naznačuje J. Brábek a dodává, že v případech časných stadií nádorů s malou nebo žádnou metastatickou zátěží by neoadjuvantní/adjuvantní použití migrastatik před chirurgickým odstraněním primárního nádoru a po jeho odstranění mohlo představovat jejich efektivní využití. Zde by cílem migrastatické léčby bylo minimalizovat rozvoj metastáz před operací a minimalizovat riziko, že případné zbývající nádorové buňky zahájí metastatický program, například v důsledku změn v jejich mikroprostředí způsobených operací. „U pokročilých nádorů s existujícími metastázami může být opodstatněná kombinace migrastatik a cytostatik nebo jiných systémových terapií. V takových případech by migrastatikum snížilo pravděpodobnost vzniku sekundárních metastáz. Aby byla migrastatická léčba účinná i v pozdějších stadiích onkologického onemocnění, měla by být podávána dlouhodobě, a to i po ukončení cytostatické léčby. Z toho vyplývá požadavek na nízkou toxicitu migrastatik,“ konstatuje J. Brábek s tím, že v obou případech by podávání migrastatik mohlo pacientům prospět prodloužením doby celkového přežití, zabráněním vzniku dalších metastáz a v důsledku toho potenciální přeměnou zhoubného nádoru v chronické onemocnění.