Zacílení na mutaci IDH1 reálně posunuje léčbu AML
Akutní myeloidní leukémie je nejčastějším typem akutní leukémie u dospělých. Dlouhodobé výsledky terapie zůstávají u většiny nemocných neuspokojivé. Pokračující výzkum procesu maligní transformace hematopoetické kmenové buňky poodhalil nové mutace, které představují atraktivní cíle pro moderní léky. Ivosidenib, inhibitor mutované isocitrátdehydrogenázy 1 (IDH1), prokázal v kombinaci s azacitidinem povzbudivé výsledky u nemocných s dříve neléčenou akutní myeloidní leukémií s mutací IDH1. Hovořilo se o tom i na III. českém hematologickém a transfuziologickém sjezdu v té části programu, kterou podpořila společnost Servier.
Akutní myeloidní leukémie (AML) představuje heterogenní skupinu maligních onemocnění krvetvorby postihující hlavně starší nemocné s mediánem věku při diagnóze 68 let [1]. I zde se terapeutické možnosti neustále vyvíjejí, zejména v důsledku lepšího pochopení procesu leukemogeneze. U nemocných neschopných podstoupit intenzivní chemoterapii a alogenní transplantaci krvetvorných buněk však výsledky léčby zůstávají neuspokojivé. Aktuální posun v této oblasti hematoonkologie představuje cílené ovlivnění mutací genu kódujícího enzym isocitrátdehydrogenázu (IDH). Tento koncept nyní vstupuje do reálné klinické praxe. Léčivý přípravek Tibsovo (ivosidenib), první registrovaný lék ze skupiny tzv. inhibitorů IDH1, je recentně schválen pro neintenzivní terapii nově diagnostikovaných pacientů s AML s mutací IDH1 [2].
Mutace IDH jako terapeutický cíl byly zkoumány u celé řady maligních onemocnění. IDH1 a IDH2 jsou izoformy enzymu se známým významem v procesu maligní transformace. Mutantní IDH1 přeměňuje alfa‑ketoglutarát (a‑KG) na 2‑hydroxyglutarát (2‑HG), který blokuje buněčnou diferenciaci a podporuje nádorovou transformaci u hematologických i nehematologických malignit. Význam mutace IDH1 byl popsán nejen u AML, ale např. i u gliomu, cholangiokarcinomu či chondrosarkomu. Vzhledem k vysokému záchytu enzymové mutace u nádorových onemocnění představují IDH1 a IDH2 atraktivní cíle pro terapii. U nemocných s AML je popisován výskyt mutace IDH1 a IDH2 přibližně u sedmi až čtrnácti procent, resp. osmi až devatenácti procent nemocných. Současný výskyt obou mutací je raritní. Heterozygotní mutace IDH1 je nejčastěji lokalizována na kodonu 132 (IDH1R132). Výskyt mutace IDH1 je častěji popisován v asociaci s normálním karyotypem či záchytem mutace NPM1. Prognostický význam mutace IDH1 je nutné interpretovat komplexně, s ohledem na cytogenetický a molekulárněbiologický profil onemocnění. Frekvence mutací IDH1 u AML roste s věkem, starší pacienti tedy tuto mutaci vykazují častěji [3].
Komplexní molekulárněgenetické vyšetření pacientů s akutní myeloidní leukémií je již běžným standardem v rámci diagnostiky onemocnění s návazností na určení prognózy onemocnění a vhodné terapie. Stanovení přítomnosti mutace IDH1 je doporučeno do pěti dnů od přijetí vzorku do laboratoře, což u cílené terapie umožňuje nasazení již v prvním cyklu terapie [4].
Nemocní, kteří nejsou schopni podstoupit intenzivní léčbu, jsou kandidáty pro non‑intenzivní terapii, zahrnující monoterapii či kombinace hypometylačních látek, nízkodávkovaného cytosinarabinosidu s cílenými léky.
„Vzhledem k postupně se rozšiřujícímu spektru cílených léků je zásadní časná identifikace pacientů, kteří by mohli z ‚personalizované‘ terapie profitovat,“ uvedla na sympoziu doc. MUDr. Barbora Weinbergerová, Ph.D., Interní hematologická a onkologická klinika LF MU a FN Brno. Ve svém sdělení se mimo jiné věnovala mechanismu účinku ivosidenibu. U pacientů s AML s mutací IDH1 dochází k tomu, že mutovaná isocitrátdehydrogenáza 1 (IDH1 R132) přeměňuje alfa‑ketoglutarát na 2‑hydroxyglutarát, onkometabolit, který blokuje diferenciaci buněk a způsobuje jejich nekontrolovanou proliferaci. Ivosidenib se specificky váže na tuto mutovanou IDH1 a obnovuje normální epigenetické mechanismy myeloblastových buněk a jejich metabolismus [5].
Ivosidenib byl uveden do klinické praxe na základě dat z registrační studie AGILE. Jednalo se o mezinárodní, dvojitě zaslepenou, randomizovanou, placebem kontrolovanou studii fáze III. Z celkového počtu 146 randomizovaných nemocných ve studii bylo 72 léčeno kombinací ivosidenib + azacitidin (IVO+AZA) a 74 kombinací placebo + azacitidin (PBO+AZA). Zařazeni byli pacienti s nově diagnostikovanou AML s mutací IDH1 R132, kteří nebyli vhodní pro intenzivní léčbu. Primárním cílem studie bylo přežití bez příhody (EFS, event free survival), definované jako doba od randomizace do selhání terapie (nedosažení kompletní remise do 6 měsíců), do relapsu po předchozím dosažení remise nebo úmrtí z jakékoli příčiny. Sekundárními cílovými parametry bylo celkové přežití, kompletní remise a bezpečnost léčby [6,7,8].
Výsledky
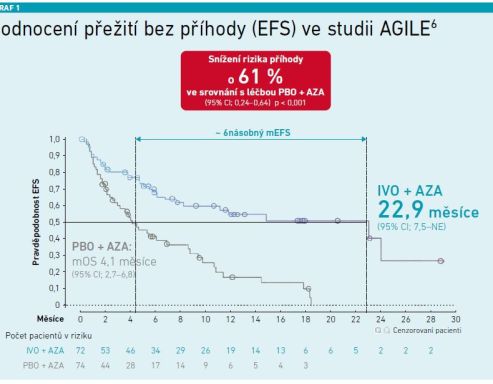 Přežití bez příhody: Pacienti léčení kombinací IVO+AZA měli medián přežití bez příhody téměř 23 měsíců oproti čtyřem měsícům u kontrolní skupiny, což představuje 61% snížení rizika příhody (viz graf 1) [6].
Přežití bez příhody: Pacienti léčení kombinací IVO+AZA měli medián přežití bez příhody téměř 23 měsíců oproti čtyřem měsícům u kontrolní skupiny, což představuje 61% snížení rizika příhody (viz graf 1) [6].
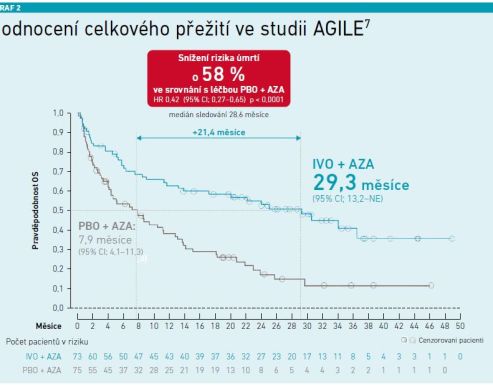 Celkové přežití: Kombinace IVO+AZA vedla v dlouhodobém sledování k významnému prodloužení mediánu celkového přežití ve srovnání s kombinací PBO+AZA (29,3 měsíce vs. 7,9 měsíce). Při léčbě kombinací IVO+AZA se riziko úmrtí snížilo o 58 procent ve srovnání s kontrolní skupinou (viz graf 2) [7].
Celkové přežití: Kombinace IVO+AZA vedla v dlouhodobém sledování k významnému prodloužení mediánu celkového přežití ve srovnání s kombinací PBO+AZA (29,3 měsíce vs. 7,9 měsíce). Při léčbě kombinací IVO+AZA se riziko úmrtí snížilo o 58 procent ve srovnání s kontrolní skupinou (viz graf 2) [7].
Kompletní remise: 47 procent pacientů na kombinované terapii IVO+AZA dosáhlo kompletní remise ve srovnání s 15 procenty pacientů léčených AZA v monoterapii; odhadovaná pravděpodobnost setrvání v kompletní remisi i po 12 měsících byla 88 procent v rameni s IVO+AZA a 36 procent v rameni s PBO+AZA [6].
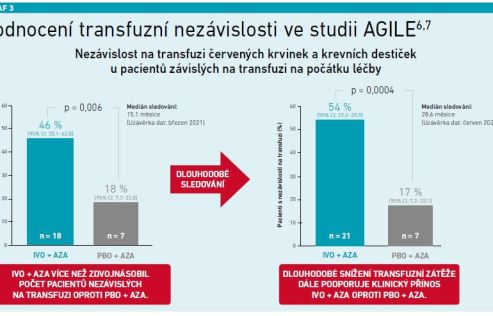 Transfuzní nezávislost: 46 procent pacientů na kombinaci IVO+AZA dosáhlo transfuzní nezávislosti oproti 18 procentům pacientů v kontrolní skupině. V dlouhodobém sledování se tento rozdíl ještě více zvýšil (54 % vs. 17 %) (viz graf 3) [6,7].
Transfuzní nezávislost: 46 procent pacientů na kombinaci IVO+AZA dosáhlo transfuzní nezávislosti oproti 18 procentům pacientů v kontrolní skupině. V dlouhodobém sledování se tento rozdíl ještě více zvýšil (54 % vs. 17 %) (viz graf 3) [6,7].
Nástup účinku: U pacientů léčených kombinací IVO+AZA došlo již během prvního cyklu k obnovení počtu neutrofilů, které se udržely na úrovni kolem 2 × 10⁹/l. Oproti tomu pacienti léčení AZA v monoterapii zůstávali často v neutropenii, což je spojeno s vyšším výskytem infekcí. Navíc kombinovaná léčba způsobila rychlý pokles počtu blastů, což se projevilo i na lepším zotavení pacientů [7,8].
Zlepšení kvality života: Kombinovaná léčba IVO+AZA vedla k signifikantnímu zlepšení kvality života pacientů ve všech sledovaných oblastech v porovnání s pacienty léčenými pouze AZA. Zlepšení bylo patrné v oblastech, jako jsou sociální a kognitivní funkce, ale také v symptomech, které výrazně ovlivňují život pacientů s AML, jako jsou nechutenství, průjem, bolest a dušnost [6].
Profil bezpečnosti ve studii AGILE
Výskyt nežádoucích účinků stupně ≥ 3 byl v obou léčebných skupinách podobný. Důležité však je, že kombinace ivosidenib + azacitidin byla spojena s nižší mírou infekcí stupně ≥ 3 ve srovnání s pacienty léčenými samotným azacitidinem. To pravděpodobně souvisí s rychlejší obnovou počtu neutrofilů. Sledované nežádoucí účinky, jako diferenciační syndrom a prodloužení intervalu QT, se vyskytly v obou skupinách, přičemž u kombinace IVO+AZA byla jejich frekvence mírně vyšší. Je však důležité zmínit, že tyto nežádoucí účinky byly převážně nízkého stupně a dobře zvládnutelné. Diferenciační syndrom byl úspěšně řešen kortikoidy, diuretiky a hydroxyureou a nedošlo k žádnému úmrtí v důsledku těchto komplikací [6].
Pokud jde o nežádoucí účinky vedoucí k přerušení nebo ukončení léčby či k úmrtí, nebyl mezi oběma skupinami výrazný rozdíl. Nejčastějšími důvody pro přerušení léčby byly neutropenie a febrilní neutropenie [6].
Další studie a guidelines
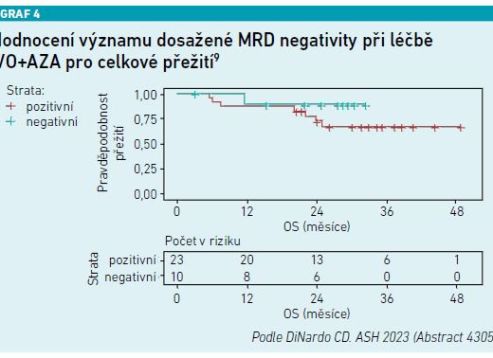 Studie vedená profesorkou Courtney DiNardovou, která byla publikována na loňském kongresu ASH (American Society of Hematology), potvrdila, že pacienti, kteří dosáhli MRD negativity (měřitelná reziduální nemoc) při léčbě kombinací IVO+AZA, měli výrazně lepší přežití bez příhody i celkové přežití (viz graf 4) [9].
Studie vedená profesorkou Courtney DiNardovou, která byla publikována na loňském kongresu ASH (American Society of Hematology), potvrdila, že pacienti, kteří dosáhli MRD negativity (měřitelná reziduální nemoc) při léčbě kombinací IVO+AZA, měli výrazně lepší přežití bez příhody i celkové přežití (viz graf 4) [9].
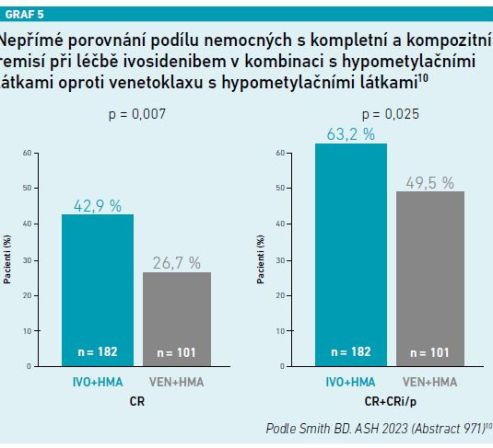 Jiná práce, která také zazněla na loňském kongresu ASH, nepřímo porovnávala léčbu pacientů s AML s mutací IDH1, kteří nejsou vhodní pro intenzivní léčbu. V tomto porovnání byli pacienti léčeni buď kombinací ivosidenib + hypometylační látky (HMA), nebo kombinací venetoklax + HMA. Výsledky prokázaly, že více pacientů na léčbě ivosidenib + HMA dosáhlo kompletní remise, včetně kompozitních remisí. Navíc šestiměsíční EFS byl lepší u pacientů léčených kombinací ivosidenib + HMA ve srovnání s pacienty léčenými kombinací venetoklax + HMA (56 % vs. 40 %) (viz graf 5). U těchto pacientů byl signifikantně nižší výskyt febrilní neutropenie během prvního cyklu léčby (2 % vs. 8 %) [10].
Jiná práce, která také zazněla na loňském kongresu ASH, nepřímo porovnávala léčbu pacientů s AML s mutací IDH1, kteří nejsou vhodní pro intenzivní léčbu. V tomto porovnání byli pacienti léčeni buď kombinací ivosidenib + hypometylační látky (HMA), nebo kombinací venetoklax + HMA. Výsledky prokázaly, že více pacientů na léčbě ivosidenib + HMA dosáhlo kompletní remise, včetně kompozitních remisí. Navíc šestiměsíční EFS byl lepší u pacientů léčených kombinací ivosidenib + HMA ve srovnání s pacienty léčenými kombinací venetoklax + HMA (56 % vs. 40 %) (viz graf 5). U těchto pacientů byl signifikantně nižší výskyt febrilní neutropenie během prvního cyklu léčby (2 % vs. 8 %) [10].
Mezinárodní doporučení ELN uvádějí, že pacienti s AML s mutací IDH1 typu R132, kteří nejsou způsobilí ke standardní indukční chemoterapii, by měli být léčeni kombinací ivosidenib + azacitidin [4]. Tato indikace byla zařazena i do Červené knihy. V kapitole o AML je zmíněn ivosidenib a jeho indikace, což potvrzuje, že má podporu i od České hematologické společnosti ČLS JEP [11].
Závěr
Iniciální testování nemocných s nově diagnostikovanou AML na přítomnost mutace IDH1 je zásadní pro identifikaci nemocných, kteří mohou z terapie ivosidenibem a azacitidinem profitovat. Klíčovou roli zde hraje rychlá diagnostika, která umožňuje včasné zahájení cílené léčby.
Kombinovaná léčba ivosidenibem a azacitidinem významně zlepšuje výsledky u pacientů s AML s mutací IDH1, kteří nejsou vhodní k intenzivní terapii, a zároveň vytváří potenciál pro následnou alogenní transplantaci. Tato kombinace má také přijatelný bezpečnostní profil a signifikantně zlepšila kvalitu života pacientů, jak bylo prokázáno v registrační studii AGILE. Kombinovaná léčba ivosidenib a azacitidin je proto součástí jak mezinárodních doporučení, tak i doporučení České hematologické společnosti, a to s cílem rychlé molekulární diagnostiky IDH1 R132 u nově diagnostikovaných AML.
Reference:
1. Databáze DATOOL (02/1993–8/2024), export dat 2024‑08‑30.
2. SPC Tibsovo. Datum poslední revize 12/2023.
3. Döhner H, Wei AH, Appelbaum FR, et al. Diagnosis and management of AML in adults: 2022 recommendations from an international expert panel on behalf of the ELN. Blood. 2022;140(12):1345–1377.
4. Döhner H, DiNardo CD, Wei AH, et al. Genetic risk classification for adults with AML receiving less‑intensive therapies: the 2024 ELN recommendations. Blood. 2024 Aug 12:blood. 2024025409. doi: 10.1182/blood.2024025409. Epub ahead of print.
5. DiNardo CD, Stein EM, de Botton S, et al. Durable Remissions with Ivosidenib in IDH1‑Mutated Relapsed or Refractory AML. N Engl J Med. 2018 Jun 21;378(25):2386–2398.
6. Montesinos P, Recher C, Vives S, et al. Ivosidenib and Azacitidine in IDH1‑Mutated Acute Myeloid Leukemia. N Engl J Med. 2022 Apr 21;386(16):1519–1531.
7. de Botton S. ASCO 2023 (Poster 142).
8. Döhner H. ASCO 2022 (Poster 273).
9. DiNardo CD. ASH 2023 (Abstract 4305).
10. Smith BD. ASH 2023 (Abstract 971).
11. Červená kniha. Léčebné postupy v hematologii 2024