Srdeční selhání – jak plně využít nové možnosti farmakoterapie v praxi?

Srdeční selhání je závažné onemocnění s vysokou a stále narůstající prevalencí. Základní pilíře farmakologické léčby srdečního selhání s redukovanou ejekční frakcí levé komory tvoří kromě diuretik ovlivňujících symptomy rovněž inhibitory angiotenzin konvertujícího enzymu/inhibitory neprilysinu a receptoru angiotenzinu II (ACEI/ARNI), betablokátory, antagonisté mineralokortikoidních receptorů a inhibitory receptoru sodíko‑glukózového kotransportéru typu 2 (SGLT2), které dokáží příznivě ovlivnit prognózu pacienta. Výsledky řady recentně publikovaných studií podporujících časné nasazení plné kombinace těchto léků v odpovídajících dávkách se odrazily i v Aktualizaci Doporučených postupů Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu srdečního selhání publikované v roce 2023. Pro využití těchto léků v praxi byla navržena řada algoritmů postihujících řešení různých klinických scénářů. K nutnosti aktualizace evropských doporučených postupů významně přispěly i výsledky studií EMPEROR‑Preserved a DELIVER, na jejichž podkladě je u pacientů se srdečním selháním s mírně redukovanou či zachovalou ejekční frakcí levé komory jednoznačně doporučena léčba empagliflozinem či dapagliflozinem.
Výskyt a prognóza srdečního selhání
Přestože srdeční selhání patří k nejčastějším kardiovaskulárním (KV) onemocněním, není jeho přesná prevalence známa. Doporučené postupy ESC pro diagnostiku a léčbu srdečního selhání z roku 2021 ji v Evropě odhadují na 1–2 % dospělé populace, nicméně konstatují, že vzhledem k poddiagnostikování tohoto onemocnění bude skutečná prevalence nejspíše vyšší.1,2 Připravovaný Národní kardiovaskulární plán předpokládá, že aktuálně trpí tímto onemocněním v České republice řádově 400 tisíc pacientů, a očekává navýšení jejich počtu na 600 tisíc do roku 2030 a zdvojnásobení oproti aktuálnímu stavu do roku 2040. Na tomto vývoji se významně podílí i stárnutí populace. Zatímco u dospělých ve věku pod 55 let se srdeční selhání vyskytuje přibližně u 1 % populace, dosahuje ve věku nad 70 let výskyt více než 10 %.3–6 Dle dat z českého Národního registru hrazených zdravotních služeb se srdeční selhání v roce 2022 vyskytovalo u 20 % populace ČR ve věkové skupině nad 75 let, přičemž v nejvyšších věkových kategoriích výskyt převyšoval 50 %. Diagnóza srdečního selhání přitom přináší svým nositelům výrazně zhoršenou prognózu. V roce 2018 publikovaná analýza Framinghamské studie a Cardiovascular Health Study dokumentuje 67% úmrtnost do pěti let od stanovení diagnózy srdečního selhání.7
K obdobně nepříznivým zjištěním došla také kohortová studie z let 2000 až 2010 provedená v hrabství Olmsted ve Velké Británii, která u pacientů se srdečním selháním zjistila jednoroční a pětiletou úmrtnost 20 %, resp. 53 %.8 Data z této studie zároveň dokládají vysokou morbiditu pacientů se srdečním selháním, která se odrazila v poměrně vysokém výskytu hospitalizací (1,3 hospitalizace na osobu a rok).
Zatímco výskyt srdečního selhání bude v důsledku stárnutí populace minimálně v krátkodobém horizontu i přes zavádění nových preventivních postupů narůstat, prognóza pacientů s již diagnostikovaným onemocněním může být příznivější než v minulosti.
Vývoj možností léčby srdečního selhání s redukovanou ejekční frakcí levé komory (HFrEF)
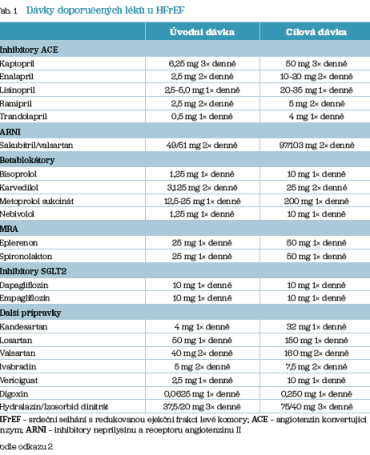 Znatelné zlepšení v této oblasti bylo zaznamenáno již mezi lety 1980–2000, kdy se na základě výsledků klinických studií do léčby rutinně zavedla prognózu ovlivňující farmakologická blokáda systému renin‑angiotenzin‑aldosteron (RAS).9–13 Následovaly publikace pozitivních výsledků studií s betablokátory (BB), antagonisty mineralokortikoidních receptorů (MRA) a ivabradinem, na jejichž základě Doporučené postupy ESC pro diagnostiku a léčbu srdečního selhání z roku 2012 zařadily tyto lékové skupiny do základního léčebného algoritmu pro léčbu pacientů se srdečním selháním s redukovanou ejekční frakcí levé komory (HFrEF).14 Na základě výsledků studie PARADIGM15 byla do základního algoritmu při aktualizaci doporučených postupů v roce 2016 pro tuto skupinu pacientů doplněna nová prognózu ovlivňující léková skupina ARNI reprezentovaná sakubitril valsartanem.16 Další významné milníky na cestě ke zlepšení prognózy pacientů s HFrEF představují bezesporu publikace výsledků studií s inhibitory SGLT2 – DAPA‑HF17 a EMPEROR‑Reduced18, které se odrazily i v recentních evropských doporučeních publikovaných v roce 2021.1 Ta na rozdíl od předchozích doporučených postupů opouštějí poměrně striktní algoritmus pro postupné nasazování léků ovlivňujících prognózu onemocnění (ACEI + BB … MRA … ARNI) a definují čtyři základní pilíře léčby k ovlivnění prognózy, kterými jsou ACEI/ARNI, BB, MRA a inhibitory SGLT2, které by měly být využity u všech pacientů s HFrEF, pokud nejsou kontraindikovány. Ke zmírnění symptomů u pacientů s kongescí je dále jasně doporučeno podání kličkových diuretik. Blokátory receptorů pro angiotenzin II jsou doporučovány pouze u pacientů netolerujících ACEI i ARNI. Do skupiny léků s nižším stupněm doporučení (léky ke zvážení) jsou pak aktuálně zařazeny ivabradin, digoxin a vericiguat. U všech zmíněných léků doporučených k léčbě HFrEF jsou uvedeny i dávky, jimiž má být léčba zahájena, a dávky cílové, které vycházejí zejména z dávkování použitého v klinických studiích prokazujících efektivitu léčby (tab. 1).
Znatelné zlepšení v této oblasti bylo zaznamenáno již mezi lety 1980–2000, kdy se na základě výsledků klinických studií do léčby rutinně zavedla prognózu ovlivňující farmakologická blokáda systému renin‑angiotenzin‑aldosteron (RAS).9–13 Následovaly publikace pozitivních výsledků studií s betablokátory (BB), antagonisty mineralokortikoidních receptorů (MRA) a ivabradinem, na jejichž základě Doporučené postupy ESC pro diagnostiku a léčbu srdečního selhání z roku 2012 zařadily tyto lékové skupiny do základního léčebného algoritmu pro léčbu pacientů se srdečním selháním s redukovanou ejekční frakcí levé komory (HFrEF).14 Na základě výsledků studie PARADIGM15 byla do základního algoritmu při aktualizaci doporučených postupů v roce 2016 pro tuto skupinu pacientů doplněna nová prognózu ovlivňující léková skupina ARNI reprezentovaná sakubitril valsartanem.16 Další významné milníky na cestě ke zlepšení prognózy pacientů s HFrEF představují bezesporu publikace výsledků studií s inhibitory SGLT2 – DAPA‑HF17 a EMPEROR‑Reduced18, které se odrazily i v recentních evropských doporučeních publikovaných v roce 2021.1 Ta na rozdíl od předchozích doporučených postupů opouštějí poměrně striktní algoritmus pro postupné nasazování léků ovlivňujících prognózu onemocnění (ACEI + BB … MRA … ARNI) a definují čtyři základní pilíře léčby k ovlivnění prognózy, kterými jsou ACEI/ARNI, BB, MRA a inhibitory SGLT2, které by měly být využity u všech pacientů s HFrEF, pokud nejsou kontraindikovány. Ke zmírnění symptomů u pacientů s kongescí je dále jasně doporučeno podání kličkových diuretik. Blokátory receptorů pro angiotenzin II jsou doporučovány pouze u pacientů netolerujících ACEI i ARNI. Do skupiny léků s nižším stupněm doporučení (léky ke zvážení) jsou pak aktuálně zařazeny ivabradin, digoxin a vericiguat. U všech zmíněných léků doporučených k léčbě HFrEF jsou uvedeny i dávky, jimiž má být léčba zahájena, a dávky cílové, které vycházejí zejména z dávkování použitého v klinických studiích prokazujících efektivitu léčby (tab. 1).
Nová data podporující časné dosažení plné kombinační léčby HFrEF
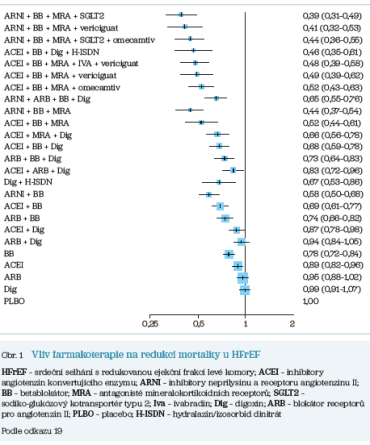 Rozšíření spektra léků příznivě ovlivňujících prognózu srdečního selhání s redukovanou ejekční frakcí levé komory představuje pro nemocné vyšší šanci na prodloužení života a zlepšení jeho kvality, ale pouze za předpokladu, že tyto léky budou u konkrétního pacienta do léčby v odpovídajících dávkách zavedeny. Využití všech čtyř pilířů prognózu ovlivňující terapie včetně ARNI redukuje v porovnání s placebem dle metaanalýzy publikované Trompem et al. v roce 202219 celkovou mortalitu o 61 % (95% interval spolehlivosti [CI] 51–69 %), kombinaci KV mortality a hospitalizací pro srdeční selhání o 64 % (95% CI 54–71 %) a samotnou KV mortalitu o 67 % (95% CI 57–74 %). Využití této čtyřkombinace u padesátiletých pacientů tak vede k prodloužení života o 7,9 roku (95% CI 4,7–11,2 roku) a u pacientů sedmdesátiletých stále ještě o 5,0 roku (95% CI 2,5–7,5 roku). Oproti tomu potenciál nekompletní protektivní léčby je pouze částečný, jak ukazuje obrázek 1.
Rozšíření spektra léků příznivě ovlivňujících prognózu srdečního selhání s redukovanou ejekční frakcí levé komory představuje pro nemocné vyšší šanci na prodloužení života a zlepšení jeho kvality, ale pouze za předpokladu, že tyto léky budou u konkrétního pacienta do léčby v odpovídajících dávkách zavedeny. Využití všech čtyř pilířů prognózu ovlivňující terapie včetně ARNI redukuje v porovnání s placebem dle metaanalýzy publikované Trompem et al. v roce 202219 celkovou mortalitu o 61 % (95% interval spolehlivosti [CI] 51–69 %), kombinaci KV mortality a hospitalizací pro srdeční selhání o 64 % (95% CI 54–71 %) a samotnou KV mortalitu o 67 % (95% CI 57–74 %). Využití této čtyřkombinace u padesátiletých pacientů tak vede k prodloužení života o 7,9 roku (95% CI 4,7–11,2 roku) a u pacientů sedmdesátiletých stále ještě o 5,0 roku (95% CI 2,5–7,5 roku). Oproti tomu potenciál nekompletní protektivní léčby je pouze částečný, jak ukazuje obrázek 1.
V klinické praxi je přitom dosažení plné kombinační léčby často oddalováno kvůli pomalé postupné titraci ve snaze vyhnout se nežádoucím účinkům léčby, zejména symptomatické hypotenzi a zhoršení glomerulární filtrace. Ve snaze o maximální bezpečnost léčby je často obětována její plná efektivita, přičemž vliv na uplatňování tohoto přístupu měla i donedávna nedostatečná evidence z klinických studií. Proto se hledání optimálního způsobu časného nasazování a titrace protektivní léčby srdečního selhání v posledních letech věnovala celá řada projektů, ve kterých byl hodnocen vliv zahájení této léčby ještě v průběhu hospitalizace pro akutní zhoršení srdečního selhání.
Studie TRANSITION20 ukázala, že u pacientů hospitalizovaných pro akutní zhoršení či de novo vzniklé srdeční selhání s ejekční frakcí levé komory (EF LK) ≤ 40 % je při zahájení podávání sakubitril valsartanu ještě při hospitalizaci nebo 14 dnů po propuštění dosažitelná titrace k efektivní dávce v poměrně krátkém čase. Ve studii PIONEER‑HF21 pak byl u obdobných pacientů hodnocen vliv při hospitalizaci nasazeného sakubitril valsartanu ve srovnání s enalaprilem. Kromě významnější redukce hodnot NT‑proBNP (N‑terminální natriuretický propeptid typu B) hodnocené osm týdnů po propuštění vedla léčba sakubitril valsartanem i ke 42% redukci kombinovaného klinického cíle – výskytu KV úmrtí či rehospitalizace pro srdeční selhání. Separace křivek výskytu těchto příhod byla přitom patrná již od prvního týdne od randomizace.22 Uvedené studie zpochybnily opodstatněnost začleňování ARNI do medikace až jako léku druhé volby po nedostatečném efektu ACEI a jejich výsledky se v Doporučených postupech ESC pro management srdečního selhání odrazily nejen ve změně algoritmu léčby HFrEF, ale i v jednoznačném doporučení, aby evidencí podpořená léčba srdečního selhání byla zahajována ještě před propuštěním z hospitalizace pro akutní srdeční selhání.
Další studie, jejichž výsledky podporují uvedený postup, byly provedeny s inhibitory SGLT2. Ve studii SOLOIST‑WHF23 u diabetiků hospitalizovaných pro akutní srdeční selhání bez vymezení EF LK vedlo nasazení sotagliflozinu před propuštěním z hospitalizace k redukci kombinovaného sledovaného cíle definovaného jako KV úmrtí či hospitalizace nebo urgentní ambulantní kontrola pro srdeční selhání o 33 % (95% CI 15–48 %; p < 0,001). Studie EMPULSE24 pak testovala při hospitalizaci pro akutní srdeční selhání nasazený empagliflozin u diabetiků i nediabetiků bez omezení EF LK. Primární hodnocený kompozitní cílový ukazatel definovaný jako „klinický přínos“ byl hierarchicky složen z výskytu úmrtí z jakékoliv příčiny, počtu příhod dekompenzace srdečního selhání, doby do první příhody srdečního selhání nebo výskytu nejméně pětibodového rozdílu ve změnách oproti výchozí hodnotě v celkovém skóre symptomů Kansas City Cardiomyopathy Questionnaire po 90 dnech a byl hodnocen pomocí statistické metody win‑ratio. Časně nasazená léčba empagliflozinem vedla oproti placebu k signifikantnímu zvýšení skóre o 36 % (poměr rizik [HR]: 1,36, 95% CI 1,09–1,68; p = 0,0054), přičemž účinnost byla nezávislá na EF LK či přítomnosti diabetu a výskyt nežádoucích příhod byl v obou hodnocených skupinách srovnatelný.
Zatímco výsledky výše uvedených recentních studií podpořily časné začlenění ARNI a inhibitorů SGLT2 do léčby pacientů s HFrEF, rovněž nedávno publikovaná studie STRONG‑HF25 poukázala i na vysokou efektivitu rychlé titrace lékových skupin, které jsou v této indikaci využívány již po několik desetiletí. Do studie byli zařazeni hospitalizovaní pro akutní srdeční selhání bez omezení EF LK, kteří ještě neužívali plné doporučené dávky terapie srdečního selhání. Ti byli před propuštěním randomizováni k obvyklé nebo k vysoce intenzivní péči, kterou představovala časná a rychlá intenzifikace perorální léčby srdečního selhání za využití ACEI, blokátorů receptorů pro angiotenzin II (ARB) či ARNI, BB a MRA. V této skupině bylo cílem dosáhnout alespoň poloviny cílových dávek doporučených léků již při první titrační vizitě během 48 hodin před propuštěním z nemocnice a plných dávek při ambulantní kontrole provedené do dvou týdnů po propuštění, pokud se tento postup nejevil zkoušejícím nevhodný. Primárním hodnoceným cílem byla kombinace rehospitalizace pro srdeční selhání a úmrtí ze všech příčin do 180 dnů od propuštění. Dosažení cílových dávek hodnocené léčby srdečního selhání bylo významně vyšší ve skupině intenzivní péče (u blokátorů RAS 55 % vs. 2 %, u BB 49 % vs. 4 % a u MRA 84 % vs. 46 %). Studie byla předčasně ukončena z důvodu jasného benefitu v rameni vysoce intenzivní péče – statisticky významně byl redukován výše uvedený primární cíl (adjustovaný RR [aRR] 0,66; 95% CI 0,50–0,86; p = 0,0021) i výskyt rehospitalizací pro srdeční selhání (aRR 0,56; 95% CI 0,38–0,81; p = 0,0011), zatímco ve vývoji počtu úmrtí ze všech příčin byl zaznamenán pouze trend ve prospěch intenzivní léčby (aRR 0,84; 95% CI 0,56–1,26; p = 0,42). V obou skupinách byl hlášen obdobný výskyt závažných nežádoucích příhod (16 % vs. 17 %) a fatálních nežádoucích příhod (5 % vs. 6 %). Výsledky studie STRONG byly jedním z podnětů k aktualizaci Doporučení ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání, jejíž překlad byl publikován v roce 202426. Ke snížení rizika rehospitalizace pro srdeční selhání nebo úmrtí je jednoznačně doporučena strategie časné a intenzivní up‑titrace léků pro léčbu srdečního selhání zahájená před propuštěním a během časných kontrol po propuštění během šesti týdnů následujících po hospitalizaci pro akutní srdeční selhání.
Praktické algoritmy při titraci léčby HFrEF
Přestože uvedená strategie časné a intenzivní up‑titrace je v aktuálních guidelines jasně doporučena, nemělo by její uplatňování v klinické praxi znamenat bezmyšlenkovité rychlé navyšování dávek všech skupin protektivní léčby bez ohledu na klinické a laboratorní nálezy u individuálního pacienta. U řady pacientů při titraci léčby srdečního selhání dojde k výskytu hypotenze, bradykardie, zhoršení glomerulární filtrace či k hyperkalemii, které nejenže mohou bránit dalšímu navyšování dávek některých léků, ale mohou vyžadovat dočasné či trvalé snížení dávky nebo úplné vysazení některé ze složek léčby srdečního selhání. Inspirací pro běžnou praxi může být personalizovaný přístup na základě fenotypů navržený Rosanem a spol.27 Jejich strategie léčby vychází ze základních fenotypových charakteristik, kterými jsou výše krevního tlaku, srdeční frekvence a přítomnost či nepřítomnost fibrilace síní, snížené glomerulární filtrace, hyperkalemie a hyperhydratace, podle nichž je volena optimální kombinace farmak pro léčbu konkrétního fenotypu. Článek dobře definuje „cílové“ kombinace vhodných léků u jednotlivých fenotypů, nevěnuje se však jednotlivým krokům k jejich dosažení. Tuto problematiku pak řeší řada dalších recentních prací, jež navrhují nové algoritmy zahájení a titrace léčby, které by měly vést k co nejrychlejšímu dosažení plného využití všech jejích komponent. McMurray a Packer řeší ve své práci28 zavedení léčby HFrEF u ambulantních pacientů ve stabilizovaném stavu a navrhují univerzální postup o třech krocích. Prvním je současné zahájení léčby betablokátory a inhibitory SGLT2, po jednom až dvou týdnech je ve druhém kroku přidána léčba ARNI, a nakonec po dalším jednom až dvou týdnech je přidán MRA. Miller a spol.29 doporučují fenotypový přístup již při iniciaci léčby – u pacientů s dominujícím objemovým přetížením doporučují jako lék první volby inhibitor SGLT2 spolu s diuretikem, u normotenzních a hypertenzních jedinců bez objemového přetížení s normální srdeční frekvencí zahájení léčby kombinací ARNI a MRA v nízkých dávkách a u pacientů se zvýšenou srdeční frekvencí pak zahájení léčby betablokátorem v kombinaci s ivabradinem. Přidání dalšího léku doporučují po dvou až čtyřech týdnech s relativně konzervativním cílem dosáhnout čtyřkombinace léků ovlivňujících prognózu v nízkých dávkách do 3–6 týdnů. Progresivnější přístup volí Greene a spol.30 – dosažení základní čtyřkombinace v nízkých dávkách v průběhu jednoho týdne (pokud je pacientem tolerováno) následované titrací jednotlivých léků k cílovým dávkám. Poměrně komplexním návrhem je práce Sharmy a spol.,31 která podrobně rozpracovává postupy pro jednotlivé klinické scénáře (stabilní pacient v ambulantní péči, de novo diagnostikované srdeční selhání, pacient hospitalizovaný pro dekompenzaci a následně propuštěný do ambulantní péče).
Vývoj doporučení pro léčbu srdečního selhání s mírně redukovanou a zachovalou ejekční frakcí levé komory (HFmrEF a HFpEF)
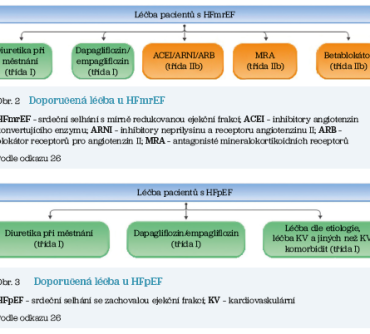 V kontrastu s pozitivním vývojem v oblasti farmakologických možností léčby pacientů s redukovanou ejekční frakcí levé komory se do roku 2021 pro podskupiny srdečního selhání s ejekční frakcí LK přesahující 40 % nedařilo identifikovat farmakologickou léčbu, kterou by bylo možno na základě evidence z klinických studií jednoznačně doporučit k ovlivnění prognózy. Zlom přinesly až publikace studií EMPEROR‑Preserved32 a DELIVER33, jejichž výsledky se rovněž významnou měrou spolupodílely na potřebě aktualizace Doporučených postupů ESC pro diagnostiku a léčbu srdečního selhání v roce 2023.26 Tato aktualizace jasně doporučuje dapagliflozin a empagliflozin i u pacientů s HFmrEF a HFpEF. Pro pacienty se srdečním selháním s mírně redukovanou EF LK jsou rovněž jednoznačně doporučována diuretika k symptomatické úlevě a dále lze na základě subanalýz řady klinických studií zvážit léčbu ACEI, ARNI či ARB, BB a MRA (obr. 2).
V kontrastu s pozitivním vývojem v oblasti farmakologických možností léčby pacientů s redukovanou ejekční frakcí levé komory se do roku 2021 pro podskupiny srdečního selhání s ejekční frakcí LK přesahující 40 % nedařilo identifikovat farmakologickou léčbu, kterou by bylo možno na základě evidence z klinických studií jednoznačně doporučit k ovlivnění prognózy. Zlom přinesly až publikace studií EMPEROR‑Preserved32 a DELIVER33, jejichž výsledky se rovněž významnou měrou spolupodílely na potřebě aktualizace Doporučených postupů ESC pro diagnostiku a léčbu srdečního selhání v roce 2023.26 Tato aktualizace jasně doporučuje dapagliflozin a empagliflozin i u pacientů s HFmrEF a HFpEF. Pro pacienty se srdečním selháním s mírně redukovanou EF LK jsou rovněž jednoznačně doporučována diuretika k symptomatické úlevě a dále lze na základě subanalýz řady klinických studií zvážit léčbu ACEI, ARNI či ARB, BB a MRA (obr. 2).
Pro srdeční selhání se zachovalou systolickou funkcí levé komory nebylo v důsledku absence jednoznačné evidence možno ani při poslední aktualizaci doporučených postupů kromě výše uvedených prognózu ovlivňujících inhibitorů SGLT2 a symptomy ovlivňujících diuretik jednoznačně doporučit jiné lékové skupiny. I v aktualizovaných guidelines ale zůstává doporučení k aktivnímu hledání a léčbě etiologie srdečního selhání a přidružených kardiovaskulárních i nekardiovaskulárních onemocnění (obr. 3).
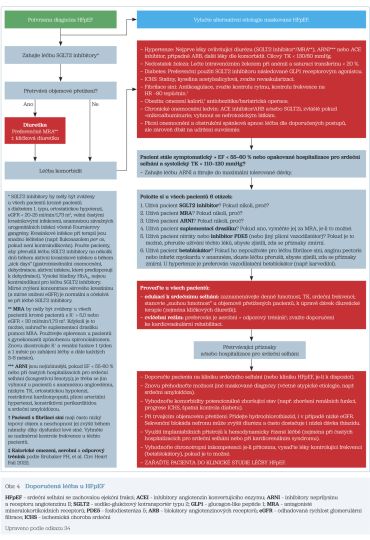 Praktickým návodem pro mnohdy nesnadnou léčbu HFpEF v klinické praxi může být i terapeutický algoritmus publikovaný v roce 2023 jako součást přehledového článku Heart Failure With Preserved Ejection Fraction: JACC Scientific Statement. První terapeutický krok po stanovení diagnózy HFpEF představuje podání inhibitoru SGLT2, po jehož nasazení je hodnoceno případné přetrvávající objemové přetížení. Pokud je přítomno, je doporučeno korigovat je diuretiky s preferencí MRA, případně diuretik kličkových. V dalším kroku je doporučena léčba komorbidit s tím, že u vybraných (hypertenze, deficitu železa, diabetu, ICHS, fibrilace síní, obezity, chronického onemocnění ledvin, plicního onemocnění a obstrukční spánkové apnoe) jsou v algoritmu doporučeny preferované léčebné postupy či cíle konkrétní léčby. Při přetrvávajících symptomech srdečního selhání a EF LK nižší než 55–60 % či opakovaných hospitalizacích pro srdeční selhání a současně při systolickém krevním tlaku vyšším než 110–120 mmHg je doporučeno zahájení léčby ARNI a titrace do maximální tolerované dávky (v Evropě ale tento postup není v souladu s terapeutickou indikací schválenou EMA). Trvající obtíže pacienta jsou důvodem ke kontrole užívané medikace, která by měla při absenci kontraindikací zahrnovat inhibitory SGLT2, ARNI a MRA. Při revizi medikace je ke zvážení nahrazení suplementace kalia MRA a zvážení nutnosti podávání inhibitorů PDE5 (fosfodiesteráza typu 5), nitrátů a betablokátorů, které samy mohou být příčinou některých obtíží pacientů s HFpEF. Doporučenou součástí léčby všech pacientů je adekvátní edukace směřující k odpovídající fyzické aktivitě a ke správnému domácímu měření a zaznamenávání tělesné hmotnosti, krevního tlaku a srdeční frekvence. Kooperujícím pacientům může být doporučeno upravování dávky některých léků (zejména diuretik) podle zjištěných hodnot. Kompletní léčebný algoritmus znázorňuje obrázek 4.
Praktickým návodem pro mnohdy nesnadnou léčbu HFpEF v klinické praxi může být i terapeutický algoritmus publikovaný v roce 2023 jako součást přehledového článku Heart Failure With Preserved Ejection Fraction: JACC Scientific Statement. První terapeutický krok po stanovení diagnózy HFpEF představuje podání inhibitoru SGLT2, po jehož nasazení je hodnoceno případné přetrvávající objemové přetížení. Pokud je přítomno, je doporučeno korigovat je diuretiky s preferencí MRA, případně diuretik kličkových. V dalším kroku je doporučena léčba komorbidit s tím, že u vybraných (hypertenze, deficitu železa, diabetu, ICHS, fibrilace síní, obezity, chronického onemocnění ledvin, plicního onemocnění a obstrukční spánkové apnoe) jsou v algoritmu doporučeny preferované léčebné postupy či cíle konkrétní léčby. Při přetrvávajících symptomech srdečního selhání a EF LK nižší než 55–60 % či opakovaných hospitalizacích pro srdeční selhání a současně při systolickém krevním tlaku vyšším než 110–120 mmHg je doporučeno zahájení léčby ARNI a titrace do maximální tolerované dávky (v Evropě ale tento postup není v souladu s terapeutickou indikací schválenou EMA). Trvající obtíže pacienta jsou důvodem ke kontrole užívané medikace, která by měla při absenci kontraindikací zahrnovat inhibitory SGLT2, ARNI a MRA. Při revizi medikace je ke zvážení nahrazení suplementace kalia MRA a zvážení nutnosti podávání inhibitorů PDE5 (fosfodiesteráza typu 5), nitrátů a betablokátorů, které samy mohou být příčinou některých obtíží pacientů s HFpEF. Doporučenou součástí léčby všech pacientů je adekvátní edukace směřující k odpovídající fyzické aktivitě a ke správnému domácímu měření a zaznamenávání tělesné hmotnosti, krevního tlaku a srdeční frekvence. Kooperujícím pacientům může být doporučeno upravování dávky některých léků (zejména diuretik) podle zjištěných hodnot. Kompletní léčebný algoritmus znázorňuje obrázek 4.
Bariéry ve využívání farmakologické léčby HF ovlivňující prognózu
Přestože farmakologická léčba příznivě ovlivňující prognózu nemocných s ejekční frakcí levé komory nad 40 % je součástí platných evropských doporučení teprve několik měsíců, je u podstatné části pacientů zplna využívána. Je to dáno zejména její jednoduchostí, kdy v současné době zahrnuje pouze inhibitory SGLT2 dapagliflozin a empagliflozin, jejichž iniciální léčebná dávka je zároveň i dávkou cílovou. Svoji pozitivní roli sehrály i dlouhodobé zkušenosti s touto terapií v indikaci léčby diabetu, jakož i kratší zkušenost s používáním u pacientů s HFrEF, stejně jako inspirace americkými doporučenými postupy35, v nichž byla tato léčba navržena již v roce 2022. Jistou bariérou pro léčbu některých nemocných zůstávají v ČR úhradové podmínky striktně vycházející z charakteristik pacientů léčených v registračních studiích, nicméně největší překážku bránící léčbě všech potřebných s HFpEF a HFmrEF představuje poddiagnostikovanost těchto typů srdečního selhání.
Základní pilíře prognózu ovlivňující léčby HFrEF jsou krom inhibitorů SGLT2 známy podstatně delší dobu a jsou u pacientů s tímto onemocněním běžně využívány, nicméně využití léčby v její plné šíři v odpovídajících dávkách jistě dosud na optimální úrovni není. V některých případech mohou v podmínkách České republiky bránit medicínsky optimální sekvenci zavádění terapie stávající pravidla úhrady ARNI a inhibitorů SGLT2 z prostředků veřejného zdravotního pojištění, jež podmiňují nasazení těchto modernějších léků předchozím využitím ACEI, ARB, BB a MRA tam, kde je to možné. Podstatně významnější bariéru však představují zaběhnuté postupy organizace péče, ve kterých mnohdy není vyhrazen čas pro relativně časté kontroly při nastavování léčby.
MUDr. Jiří Veselý
Kardiologická ambulance EDUMED s.r.o., Broumov
Lékařská fakulta v Hradci Králové, Univerzita Karlova
E‑mail: vesely.edumed@gmail.com
Literatura
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for thediagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021;42: 3599–3726. https://doi.org/10. 1093/eurheartj/ ehab368
- Málek F, Veselý J, Pudil R, et al. Souhrn Doporučených postupů Evropské kardiologické společnosti pro diagnostiku a léčbu srdečního selhání z roku 2021. Cor Vasa 2022;64:121–162.
- van Riet EE, Hoes AW, Wagenaar KP, et al. Epidemiology of heart failure: the prevalence of heart failure and ventricular dysfunction in older adults over time. A systematic review. Eur J Heart Fail 2016;18:242252.
- Benjamin EJ, Virani SS, Callaway CW, et al. American Heart Association Council on Epidemiology and Prevention Statistics Committee and Stroke Statistics Subcommittee. Heart disease and stroke statistics—2018 update: a report from the American Heart Association. Circulation 2018;137:e67e492.
- Ceia F, Fonseca C, Mota T, et al. EPICA Investigators. Prevalence of chronic heart failure in Southwestern Europe: the EPICA study. Eur J Heart Fail 2002;4:531539.
- Bibbins‑Domingo K, Pletcher MJ, et al. Racial differences in incident heart failure among young adults. N Engl J Med 2009;360:11791190.
- Tsao CW, Lyass A, Enserro D, et al. Temporal trends in the incidence of and mortality associated with heart failure with preserved and reduced ejection fraction. JACC Heart Fail 2018;6:678685.
- Gerber Y, Weston SA, Redfield MM, et al. A contemporary appraisal of the heart failure epidemic in Olmsted County, Minnesota, 2000 to 2010. JAMA Intern Med 2015;175:9961004.
- Roger VL, Weston SA, Redfield MM, et al. Trends in heart failure incidence and survival in a community‑based population. JAMA 2004;292:344350.
- Barasa A, Schaufelberger M, Lappas, et al. Heart failure in young adults: 20‑year trends in hospitalization, aetiology, and case fatality in Sweden. Eur Heart J 2014;35:2532.
- Jhund PS, Macintyre K, Simpson CR, et al. Long‑term trends in first hospitalization for heart failure and subsequent survival between 1986 and 2003: a population study of 5.1 million people. Circulation 2009;119:515523.
- Dunlay SM, Redfield MM, Weston SA, et al. Hospitalizations after heart failure diagnosis a community perspective. J Am Coll Cardiol 2009;54:16951702.
- Taylor CJ, Ordonez‑Mena JM, Roalfe AK, et al. Trends in survival after a diagnosis of heart failure in the United Kingdom 2000‑2017: population based cohort study. BMJ 2019;364:l223
- McMurray JJV, Adamopoulos S, Anker SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of ESC Guidelines 2195 Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart. Eur J Heart Fail 2012;14:803–869.
- McMurray JJ, Packer M, Desai AS, et al. Angiotensin‑neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.
- Ponikowski P, Voors AA, Anker SD, et al.; ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129–2200.
- McMurray JJV, Solomon SD, Inzucchi SE, et al. DAPA‑HF Trial Committees and Investigators. Dapagliflozin in patients with heart failure and reduced ejection fraction. N Engl J Med 2019;381:1995–2008.
- Packer M, Anker SD, Butler J, et al. EMPEROR‑Reduced Trial Investigators. Cardiovascular and renal outcomes with empagliflozin in heart failure. N Engl J Med 2020;383:1413–1424.
- Tromp J, Ouwerkerk W, van Veldhuisen DJ, et al. A systematic review and network meta‑analysis of pharmacological treatment of heart failure with reduced ejection fraction. JACC Heart Fail 2022;10:73–84.
- Wachter R, Senni M, Belohlavek J, et al. Initiation of sacubitril/valsartan in haemodynamically stabilised heart failure patients in hospital or early after discharge: primary results of the randomised TRANSITION study. Eur J Heart Fail 2019;21:998–1007.
- Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin‑neprilysin inhibition in acute decompensated heart failure. N Engl J Med 2019;380:539–548.
- Morrow DA, Velazquez EJ, DeVore AD, et al. Clinical Outcomes in Patients With Acute Decompensated Heart Failure Randomly Assigned to Sacubitril/Valsartan or Enalapril in the PIONEER‑HF Trial. Circulation 2019;139:2285–2288.
- Bhatt DL, Szarek M, Steg PG, et al., SOLOIST‑WHF Trial Investigators. Sotagliflozin in patients with diabetes and recent worsening heart failure. N Engl J Med 2021;384:117–128.
- Voors AA, Angermann CE, Teerlink JR, et al. The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med 2022;28:568–74. https://doi.org/10.1038/s41591‑ 021‑01659‑1
- Mebazaa A, Davison B, Chioncel O, et al. Safety, tolerability and efficacy of up‑titration of guideline‑directed medical therapies for acute heart failure (STRONG‑HF): a multinational, open‑label, randomised, trial. Lancet 2022;400:1938–1952. https://doi.org/10.1016/S0140‑6736(22)02076‑1
- Krejčí J, Špinarová L, Pařenica J, et al. Aktualizace Doporučení ESC pro diagnostiku a léčbu akutního a chronického srdečního selhání 2021. Vypracovaná Pracovní skupinou pro diagnostiku a léčbu akutního a chronického srdečního selhání Evropské kardiologické společnosti (ESC). Se zvláštním přispěním Evropské asociace srdečního selhání ESC. Cor Vasa 2024;66:280–288.
- Rosano GMC, Moura B, Metra M, et al. Patient profiling in heart failure for tailoring medical therapy. A consensus document of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2021;23:872–881.
- McMurray JJV, Packer M. How should we sequence the treatments for heart failure and a reduced ejection fraction?: A redefinition of evidence‑based medicine. Circulation 2021:143:875–877.
- Miller RJH, Howlett JG, Fine NM. A novel approach to medical management of heart failure with reduced ejection fraction. Can J Cardiol 2021;37:632–643.
- Greene SJ, Butler J, Fonarow GC. Simultaneous or rapid sequence initiation of quadruple medical therapy for heart failure‑optimizing therapy with the need for speed. JAMA Cardiol 2021;6:743–744.
- Sharma A, Verma S, Bhatt DL, et al. Optimizing Foundational Therapies in Patients With HFrEF. How Do We Translate These Findings Into Clinical Care? J Am Coll Cardiol Basic Trans Science 2022;7:504–517.
- Anker SD, Butler J, Filippatos G, et al. EMPEROR‑Preserved Trial Investigators. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021;385:1451–1461.
- Solomon SD, McMurry JJV, Claggett B, et al. for the DELIVER Trial Committees and Investigators. N Engl J Med 2022;387:1089‑1098
- Borlaug BA, Sharma K, Shah SJ et al. Heart Failure With Preserved Ejection Fraction: JACC Scientific Statement. J Am Coll Cardiol 2023;81:1810–1834. doi: 10.1016/j.jacc.2023.01.049. Epub 2023 Apr 19. PMID: 37137592
- Freidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA guideline for the management of heart failure: a report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation 2022;145:e895–e1032.