Souvislosti mezi tepenným a žilním onemocněním
Chronické žilní onemocnění a chronické nemoci tepen se většinou skloňují v rozdílných kontextech. Obě tyto domény přitom mají mnoho anatomických i funkčních průniků. Kromě toho existují přesvědčivá data i pro to, že onemocnění žil a tepen spolu souvisejí prognosticky. „Společným jmenovatelem správné funkce tepenného a žilního systému je endotel. Už dlouho je známo, že výstelka krevních cév není rigidní struktura, ale dynamický orgán s vlastním metabolismem a pestrou komunikací s blízkým i vzdálenějším prostředím. Jak onemocnění tepen, tak onemocnění žil potom provází určitá míra endoteliální dysfunkce. Venoprotektiva, mezi něž patří mikronizovaná purifikovaná flavonoidní frakce (MPFF®, obsaženo v přípravku Detralex®), působí pozitivně mimo jiné právě na endotel a jsou v kombinaci s modifikacemi životního stylu základním kamenem managementu chronického žilního onemocnění (CVD). Jestli má účinná terapie žilních patologií pozitivní vliv i na tepenný systém, ale bude předmětem dalšího výzkumu,“ řekla na 50. angiologických dnech v Praze doc. MUDr. Debora Karetová, CSc., z II. interní kliniky 1. LF UK a VFN v Praze. Tuto část programu podpořila společnost Servier.
Onemocnění žil a makrovaskulární i mikrovaskulární poškození tepen sdílejí některé rizikové faktory, jako je obezita, arteriální hypertenze, kouření či metabolický syndrom. Zároveň jejich extrémní formy v podobě bércových vředů vykazují smíšenou etiologii až v 26 procentech případů [1]. Klíčovým společným jmenovatelem je endoteliální dysfunkce, která hraje roli jak v rozvoji aterosklerózy, tak v patogenezi CVD. Chronický zánět, oxidační stres a protrombogenní stavy přispívají k poškození endotelu, což může vést k progresi obou typů onemocnění. Výsledkem je na jedné straně insuficience žilního systému, jejímž konečným stadiem jsou velké trombózy nebo vznik bércových vředů, na straně druhé potom katastrofické kardiovaskulární příhody typu infarktu myokardu (IM), cévní mozkové příhody (CMP) a těžké ischemické choroby dolních končetin (ICHDK) se ztrátou končetin. „Endotel sice představuje lokálně tenkou bariéru, kumulativně ale zahrnuje asi 700 m2 a váží asi 1–1,5 kg. Reálně se tak jedná o orgán, který je v organismu všudypřítomný a má klíčový regulační vliv na jeho fyziologické funkce. Při endoteliální dysfunkci dochází k jejich narušení, což se odráží do porušení vaskulárního tonu s patologickou vazokonstrikcí, abnormální adheze krevních buněk (trombocytů, leukocytů), zvýšené permeability cévní stěny, ukládání lipidů a proliferace hladkých svalových buněk. Systém je navíc velmi složitý, na vaskulární regulaci se podílejí buňky imunitního systému a celá řada působků včetně cyklooxygenázy, tromboxanů, prostacyklinů nebo oxidu dusnatého [2],“ popsala doc. Karetová a dále se zamyslela nad souvislostí CVD a zánětu: „Aterosklerotické postižení tepen představuje jednoznačně chronický zánětlivý stav a souvisí s dalšími poruchami, jako je psoriáza, revmatoidní artritida nebo i parodontitida [3]. Stále častěji se ale ukazuje, že i žilní patologie jsou s chronickým zánětem úzce spojeny. Může se tak rozvinout bludný kruh, ve kterém CVD provází zánět a ten dále potencuje zhoršení stavu žil. Vzhledem ke společným rizikovým faktorům CVD a pravděpodobně i patofyziologickým a etiologickým průnikům není překvapivé, že přítomnost CVD prokazatelně predikuje horší kardiovaskulární prognózu ve smyslu závažných klinických příhod i celkové mortality, například na základě zjištění velké longitudinální studie Gutenberg Heart Study [4]. CVD přitom často manifestní aterosklerotické postižení časově významně předchází, a její přítomnost by tak klinika měla vést k příslušným intervencím. Vedle opatření životního stylu a farmakoterapie žilních onemocnění, například pomocí MPFF®, by měl aktivně pátrat po přítomnosti hypertenze, dyslipidémie nebo diabetu a adekvátně je zaléčit.“
Společní vaskulární jmenovatelé
Tématu společných vaskulárních jmenovatelů se věnoval také doc. MUDr. Jean‑Claude Lubanda, Ph.D., rovněž z 1. LF UK a VFN v Praze: „Tepny a žíly se od sebe odlišují, stavba jejich stěny je ale do jisté míry podobná, liší se spíše v poměrech jednotlivých složek. Vnitřní vrstvu tvoří intima s endotelem, ve střední medii jsou především různě uspořádané hladké svalové buňky a vnější vrstvu tvoří adventicie. Ačkoli mají tepny a žíly rozdílné funkce, v intersticiu jsou na úrovni kapilár oba systémy úzce propojeny. Není proto překvapivé, že patologie tepen a žil sdílejí společné rizikové faktory, především vyšší věk, nedostatek pohybu, kouření nebo obezitu. Stejně tak jejich úspěšné intervence vedou ke zpomalení progrese obou typů onemocnění,“ popsal a pokračoval: „Chronický zánět, který probíhá na pozadí aterosklerotických i patologických žilních procesů, způsobuje přestavbu cévní stěny a její fibrotizaci. V tepnách se nadměrně ukládají lipidové látky, céva stenotizuje a může dojít k ruptuře plátu a trombotickým komplikacím. V žilním systému zánětlivé děje vedou spíše k narušení mechanismů žilního návratu, dilataci kapilár, stáze toku a uvolnění proteolytických enzymů [5]. Na tyto děje reagují buňky imunitního systému, které dále potencují remodelační a zánětlivé procesy, v endotelu se ve zvýšené míře exprimují komponenty inflamazomu. Buňky endotelu se protahují, ztrácejí soudržnost, ve zvýšené míře dochází k transudaci bílkovin do intersticia a narušení jeho vnitřního prostředí. V končetinách se potom rozvíjejí chronické trofické změny a stoupá riziko vzniku obtížně řešitelných bércových vředů. Ačkoli jsou žilní zánětlivé procesy zpravidla plíživější než ty aterosklerotické a méně často vedou přímo k úmrtí, pro pacienty představují značnou zátěž. Jedná se totiž o stavy s nepříjemnými symptomy, které mohou vést k dlouhodobým pracovním neschopnostem a snižují kvalitu života [6].“
Souvislost mezi onemocněními tepenného a žilního systému byla pozorována v řadě korelačních studií, obsáhlá longitudinální populační data ale přinesla až v roce 2021 analýza z německé Gutenberg Heart Study [4]. Jejím cílem bylo poskytnout aktuální údaje o prevalenci jednotlivých forem CVD dle věku a pohlaví, mapovat zátěž kardiovaskulárními rizikovými faktory a komorbiditami v celém spektru tíže žilních onemocnění a vyhodnotit význam CVD pro prognózu v obecné populaci. Vstupní vyšetření zahrnovalo standardizovaný soubor testů, posouzení kardiovaskulárních rizikových faktorů a komorbidit a laboratorní rozbor. Telefonická kontrola proběhla po 2,5 letech, závěrečná prohlídka po pěti letech. Dále byly od státních registračních úřadů získány informace o mortalitě ze všech příčin. Celkem byla získána data od 12 423 osob ve věku 40–80 let, u kterých byla provedena fenotypizace CVD na základě systému CEAP (Clinical‑Etiologic‑Anatomic‑Pathophysiologic) a následně byly dlouhodobě sledovány. Kardiovaskulární onemocnění byla souhrnně definována jako fibrilace síní, městnavé srdeční selhání, onemocnění koronárních a periferních tepen, iktus nebo žilní tromboembolismus. „Teleangiektazie nebo retikulární cévy (C1) byly vstupně přítomny u 36,5 procenta souboru, varikozity (C2) u 13,3 procenta, pokročilá CVD (C3–C6) byla vyjádřena u 40,8 procenta. Pouze 9,4 procenta populace nevykazovalo žádné klinické známky CVD. Žilní nedostatečnost se častěji týkala starších osob, žen, hypertoniků, obézních, kuřáků a těch s již vyjádřeným kardiovaskulárním onemocněním,“ popsal doc. Lubanda a pokračoval: „Vyšší třídy CEAP byly u těch, u kterých dosud žádné kardiovaskulární onemocnění nebylo vstupně patrné (n = 9 923), spojeny s vyšším desetiletým rizikem jeho rozvoje dle Framinghamského skóre kardiovaskulárních rizik.
S výjimkou chronické obstrukční plicní nemoci vykazovaly všechny kardiovaskulární komorbidity nejvyšší prevalenci u pacientů s pokročilými projevy žilní nedostatečnosti (C4–C6).
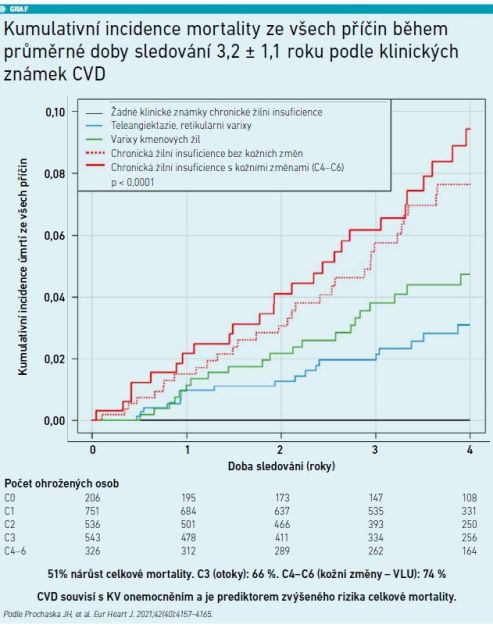 Během průměrné délky sledování 6,4 roku se CVD ukázala jako silný prediktor celkové mortality (hazard ratio [HR] 1,46; 95% konfidenční interval [CI] 1,19–1,79; p = 0,0003), a to nezávisle na věku, pohlaví nebo přítomných kardiovaskulárních rizikových faktorech a komorbiditách. Tato studie tak představuje dosud největší populační výzkum v rámci celého spektra CVD. Ukázala, že CVD má vysokou prevalenci v populaci, kardiovaskulární onemocnění a CVD spolu vzájemně souvisejí a mají společné rizikové faktory a CVD představuje silný prediktor mortality ze všech příčin v obecné populaci nad rámec stanovených rizikových faktorů (viz graf).“
Během průměrné délky sledování 6,4 roku se CVD ukázala jako silný prediktor celkové mortality (hazard ratio [HR] 1,46; 95% konfidenční interval [CI] 1,19–1,79; p = 0,0003), a to nezávisle na věku, pohlaví nebo přítomných kardiovaskulárních rizikových faktorech a komorbiditách. Tato studie tak představuje dosud největší populační výzkum v rámci celého spektra CVD. Ukázala, že CVD má vysokou prevalenci v populaci, kardiovaskulární onemocnění a CVD spolu vzájemně souvisejí a mají společné rizikové faktory a CVD představuje silný prediktor mortality ze všech příčin v obecné populaci nad rámec stanovených rizikových faktorů (viz graf).“
Doc. Lubanda se dále zamyslel, jakým způsobem snížit riziko progrese CVD, respektive jak tuto progresi zpomalit. V tomto smyslu zmínil otevřenou, jednoramennou studii provedenou na 30 pacientech s časnými symptomy konzistentními s žilní patologií ve stadiu C0 a C1, jejich průměrný věk dosáhl 51,3 roku [7]. Nemocným byla nasazena MPFF® v dávce 2× 500 mg denně. Během prvních tří měsíců léčby klesl mikrovenózní reflux o 48 procent, po šesti měsících dokonce o 65 procent. „Časná léčba venoaktivním lékem tak byla spojena s podstatným hemodynamickým efektem a obnovením kompetence na úrovni mikrochlopně. Aktivní léčba MPFF® tak může ovlivnit přímo patofyziologický mechanismus vzniku onemocnění a zabránit jeho progresi do těžších stadií,“ komentoval doc. Lubanda a dodal: „Podle současných klinických doporučení má MPFF® vliv jak na žilní tonus, stěnu a chlopně, tak na kapilární permeabilitu, posílení lymfatické drenáže a hemoreologické parametry, látky kromě toho působí antioxidačně. Vždy ale platí, že by použití MPFF® mělo být součástí komplexního klinického přístupu, který zahrnuje preventivní opatření stran rizikových faktorů, kompresní pomůcky, režimová opatření, farmakologickou a invazivní léčbu. Pro zabránění progresi CVD je třeba léčit komplexně, včas a dlouhodobě s využitím všech dostupných možností [8].“
Operativní řešení zánětlivých komplikací cévních onemocnění
Chirurgický pohled na souvislost mezi onemocněním tepen a žil přinesla doc. MUDr. Lenka Veverková, Ph.D., z I. chirurgické kliniky LF MU a FN u sv. Anny v Brně. „CVD je provázeno zánětem, a právě zánětlivé komplikace jsou častou příčinou vyhledání odborné pomoci. Pacienti totiž zejména do fakultní nemocnice přicházejí až s komplikacemi, mezi něž patří například krvácení z varikózních žil, zhojený bércový vřed, lipodermatoskleróza, varikoflebitida nebo flebotrombóza. Moderní diagnostika se opírá o dopplerovskou a nověji spíše duplexní ultrasonografii, možná je rovněž MR flebografie,“ řekla a dále představila vlastní soubor pacientů operovaných na I. chirurgické klinice v období 2013–2024: „Jednalo se celkem o 27 009 nemocných v průměrném věku 56,9 roku. Ze všech operovaných pacientů během stejné hospitalizace zemřelo 343, propuštění do ambulantní péče se ale přímo zdařilo jen u 22 905 z nich, což odráží míru komorbidit souboru. Přes 4 000 pacientů se totiž muselo doléčovat na jiných odděleních, respektive v léčebnách dlouhodobě nemocných [9].“
Doc. Veverková se nadále věnovala podskupině pacientů, které sama operovala a pro něž proto měla k dispozici rozšířená data: „Tato analýza zahrnuje celkem 1 112 pacientů operovaných s diagnózou I839. Převážně se v 72,5 procenta případů jednalo o ženy. Zajímavé bylo, že průměrný věk pacientů v čase stoupal (53,9 roku v roce 2013; 64,2 roku v roce 2024), což může odrážet stárnutí české populace, způsobeno to ale může být také redistribucí nemocných mezi zdravotnickými zařízeními. Zatímco v roce 2013 pacienti více vybírali nejbližší zařízení podle místa bydliště, později zažila rozmach různá soukromá pracoviště jednodenní chirurgie, která disproporčně lákají mladší a méně rizikové osoby. Souvislost mezi přítomností CVD a dalšími kardiovaskulárními chorobami ale byla zjevná i v našem souboru, byť se nejednalo o longitudinální sledování. Alespoň jedním dalším kardiovaskulárním onemocněním vedle CVD totiž trpělo 51,3 procenta z nich. Nejčastěji se jednalo o hyperlipidémii a arteriální hypertenzi, frekventně se objevoval rovněž diabetes a chronická ischemická choroba srdeční. Tyto údaje jsou navíc pravděpodobně podhodnoceny, protože jsou k dispozici, jen pokud ošetřující lékař zapsal příslušnou číselnou diagnózu. Každopádně ale platí, že u kohorty pacientů s CVD je namístě po dalším kardiovaskulárním onemocnění aktivně pátrat a v případě záchytu je adekvátně intervenovat. Zároveň je třeba se věnovat ošetření endoteliální dysfunkce a pokud možno snížení zánětlivé nálože, což umožňují například venoprotektiva včetně MPFF®,“ dodala.
Zdroje:
- Hedayati N, Carson JG, Chi YW, et al. Management of mixed arterial venous lower extremity ulceration: A review. Vasc Med. 2015;20(5):479–486.
- Schrottmaier WC, Assinger A. The Concept of Thromboinflammation. Hamostaseologie. 2024;44(1):21–30.
- Engelen SE, Robinson AJB, Zurke YX, et al. Therapeutic strategies targeting inflammation and immunity in atherosclerosis: how to proceed? Nat Rev Cardiol. 2022;19(8):522–542.
- Prochaska JH, Arnold N, Falcke A, et al. Chronic venous insufficiency, cardiovascular disease, and mortality: a population study. Eur Heart J. 2021;42(40):4157–4165.
- Mach F, Baigent C, Catapano AL, et al.; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020;41(1):111–188.
- Raffetto JD, Mannello F. Pathophysiology of chronic venous disease. Int Angiol. 2014;33(3):212–221.
- Lugli M, et al. Effect of micronized purifies flavonoid fraction treatment on microscopic venous valves reflux in C0’s and C1’s patients with chronic venous disease. EVF 2021 abstract.
- Nicolaides A, Kakkos S, Baekgaard N, et al. Management of chronic venous disorders of the lower limbs. Guidelines According to Scientific Evidence. Part I. Int Angiol. 2018;37(3):181–254.
- Sběr dat z hospitalizačního systému NIS‑Hosp. FNUSA Brno, I. chirurgická klinika.