Registr ATTRA přibližuje českou revmatologii té světové
Letošní 66. výroční sjezd českých a slovenských revmatologů, který se konal od 12. do 14. října v Hradci Králové, přinesl i nejnovější data z registru biologické léčby ATTRA, v jehož rámci byla provedena i analýza pacientek, u kterých došlo ke switchi na certolizumab pegol z důvodů plánované gravidity, aktuální gravidity nebo kojení.
Certolizumab pegol (CZP) je lék, který může být podáván pacientkám nejen v průběhu těhotenství, ale i v době kojení. Již studie CRIB ukázala, že tento přípravek díky svým farmakokinetickým vlastnostem neprochází transplacentárně ani do mateřského mléka, a proto jsou pacientky v době plánování gravidity, aktuální gravidity nebo kojení switchovány z jiných léků právě na CZP.
Podrobná data týkající se této problematiky přináší klinický registr ATTRA, projekt zastřešující řadu klinických registrů, které jsou od počátku roku 2002 vedeny pod odbornou garancí České revmatologické společnosti ČLS JEP. Na tomto multicentrickém projektu hodnocení průběhu a výsledků biologické léčby zánětlivých revmatických onemocnění spolupracují významná česká revmatologická pracoviště a celý systém je otevřený pro případný vstup dalších účastníků.
S výsledky analýzy pacientek, u kterých došlo ke switchi na certolizumab pegol (Cimzia) z důvodu plánované gravidity, gravidity anebo kojení, seznámil přítomné koordinátor registru ATTRA doc. MUDr. Jakub Závada, Ph.D., z Revmatologické kliniky 1. LF UK a Revmatologického ústavu v Praze. „Snahou naší analýzy bylo především zjistit, zda switch nevede ke zhoršení kontroly onemocnění, než kdyby pacientky pokračovaly na dosavadní léčbě,“ vysvětlil.
Finální analýzy se zúčastnilo 84 pacientek s diagnózami ankylozující spondylitida (AS, n = 35), psoriatická artritida (PsA, n = 10) a revmatoidní artritida (RA, n = 43), které plánovaly graviditu, byly gravidní nebo kojily. Průměrný věk pacientek při nasazení CZP byl 32,5 roku. Nejvíce (39 %) žen bylo ve věku 33–37 let. U dvou třetin pacientek byl CZP nasazován v druhé linii léčby (ve 3. linii 23,8 %, ve 4. linii 9,5 %). Nejčastěji, u 24 procent pacientek, byl CZP nasazen po adalimumabu (Humira). Pacientky s periferním postižením, tedy ženy s RA a PsA, byly hodnoceny pomocí DAS28 (Disease Activity Score), ženy s axiálním postižením (AS) prostřednictvím ASDAS (Ankylosing Spondylitis Disease Activity Score).
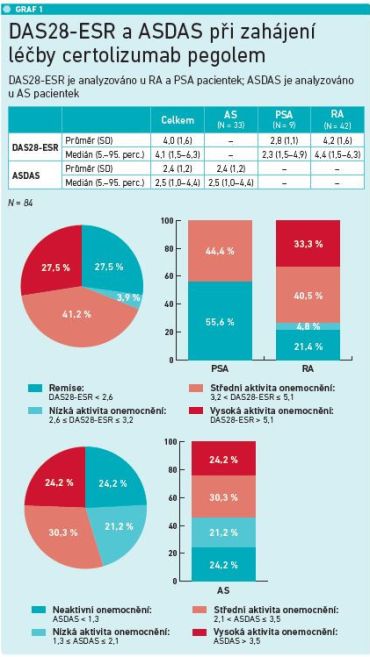 Hodnocení probíhalo v době před switchem, těsně po něm a následně tři a šest měsíců od zahájení léčby CZP. V době, než došlo ke switchi, bylo nezanedbatelné množství pacientek s PsA a RA s vysokou aktivitou onemocnění (27,5 %). Zatímco ženy s PsA měly maximálně střední aktivitu onemocnění, celá třetina pacientek s RA měla v době změny léčby vysokou aktivitu onemocnění. Pacientky s AS měly podle ASDAS vysokou aktivitu nemoci ve 24,2 procenta případů (viz graf 1). „Setrvání na léčbě po switchi bylo velmi dobré a medián po tom, co byly převedeny na léčbu CZP z jiného důvodu, než byl výskyt nežádoucích účinků nebo selhání předchozí léčby, byl téměř 50 měsíců. Znamená to, že kompozit účinnosti a bezpečnosti CZP byl velmi dobrý,“ zhodnotil doc. Závada.
Hodnocení probíhalo v době před switchem, těsně po něm a následně tři a šest měsíců od zahájení léčby CZP. V době, než došlo ke switchi, bylo nezanedbatelné množství pacientek s PsA a RA s vysokou aktivitou onemocnění (27,5 %). Zatímco ženy s PsA měly maximálně střední aktivitu onemocnění, celá třetina pacientek s RA měla v době změny léčby vysokou aktivitu onemocnění. Pacientky s AS měly podle ASDAS vysokou aktivitu nemoci ve 24,2 procenta případů (viz graf 1). „Setrvání na léčbě po switchi bylo velmi dobré a medián po tom, co byly převedeny na léčbu CZP z jiného důvodu, než byl výskyt nežádoucích účinků nebo selhání předchozí léčby, byl téměř 50 měsíců. Znamená to, že kompozit účinnosti a bezpečnosti CZP byl velmi dobrý,“ zhodnotil doc. Závada.
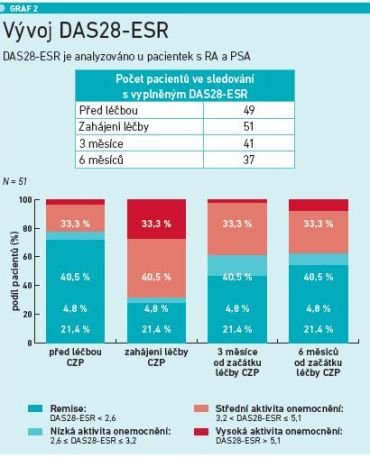 Kontroly před switchem a v průběhu léčby CZP (3. a 6. měsíc) neukazují významný rozdíl v aktivitě onemocnění, i když v okamžiku switche u pacientek s RA a PsA dle DAS28 pacientek s vysokou aktivitou nemoci přibylo, následně jejich počet opět klesl a byl srovnatelný s kontrolou před switchem. Také u pacientek s axiálním onemocněním došlo při změně léčby ke zvýšení aktivity onemocnění, záhy se však vrátilo minimálně na úroveň před switchem. Zatímco před změnou léčby bylo v této skupině 6,7 procenta pacientek s vysokou aktivitou onemocnění, v době switche to bylo 24,2 procenta, ale tři a šest měsíců od zahájení léčby CZP nevykazovala vysokou aktivitu onemocnění žádná pacientka a postupně přibývalo i těch s neaktivním onemocněním (před switchem 50 %, 6 měsíců po switchi 45 %) a nízkou aktivitou nemoci (26,7 % před vs. 35 % šest měsíců po switchi) (viz graf 2).
Kontroly před switchem a v průběhu léčby CZP (3. a 6. měsíc) neukazují významný rozdíl v aktivitě onemocnění, i když v okamžiku switche u pacientek s RA a PsA dle DAS28 pacientek s vysokou aktivitou nemoci přibylo, následně jejich počet opět klesl a byl srovnatelný s kontrolou před switchem. Také u pacientek s axiálním onemocněním došlo při změně léčby ke zvýšení aktivity onemocnění, záhy se však vrátilo minimálně na úroveň před switchem. Zatímco před změnou léčby bylo v této skupině 6,7 procenta pacientek s vysokou aktivitou onemocnění, v době switche to bylo 24,2 procenta, ale tři a šest měsíců od zahájení léčby CZP nevykazovala vysokou aktivitu onemocnění žádná pacientka a postupně přibývalo i těch s neaktivním onemocněním (před switchem 50 %, 6 měsíců po switchi 45 %) a nízkou aktivitou nemoci (26,7 % před vs. 35 % šest měsíců po switchi) (viz graf 2).
„Analyzovali jsme 84 pacientek převedených na CZP z důvodu plánované nebo aktuální gravidity. Potvrdilo se, že změna přípravku neměla negativní vliv na kontrolu aktivity onemocnění. Následné dlouhé setrvání na léčbě svědčilo pro dobrou účinnost, bezpečnost a toleranci certolizumabu,“ shrnul doc. Závada s tím, že cílem aktivity bylo i sledování, zda po switchi z jiné příčiny než z důvodu nežádoucích účinků nebo poklesu efektivity nedojde ke zhoršené kontrole onemocnění.
Význam registru ATTRA i v mezinárodním měřítku
Registry lékařských dat v ČR začaly vznikat hlavně kvůli sledování dlouhodobé bezpečnosti a efektivity terapie, ale pomáhají také zodpovídat otázky o dlouhodobé udržitelnosti léčby, výsledcích switchování terapií, nákladové efektivitě atd. ATTRA je jediný funkční registr biologické léčby ve východní Evropě, v ČR je do něj zapojeno 61 center léčby dospělých pacientů a osm center pro dětské pacienty napříč celou republikou a přibližuje revmatologii v ČR k té ve vyspělých zemích, s nimiž spolupracuje. I proto jsou např. nežádoucí účinky léčby standardně kategorizovány pomocí terminologie MedDRA (Medical Dictionary for Regulatory Activities), mimo jiné z důvodu, aby data z registru ATTRA mohla případně sloužit pro potřeby společných analýz světových registrů.
Celý projekt prošel v roce 2012 revitalizací, která byla nutná pro přizpůsobení projektu aktuálním potřebám. V současnosti stoupají nároky na kvalitu sbíraných dat, klade se větší důraz na dlouhodobé sledování pacientů, a to i po vysazení biologické léčby, a možnost srovnávat výsledky biologické léčby s vhodným komparátorem, tj. kontrolní skupinou. Tyto požadavky byly formulovány například expertní skupinou EULAR v roce 2010 a přirozeně vyplývají ze základního poslání registru, kterým je sledování a komplexní analýza bezpečnosti a reálné efektivity biologické léčby v praxi.
Registr ATTRA dnes poskytuje cenná data nejen pro zdravotní pojišťovny, jeho přínos spočívá i v tom, že se jedná také o výzkumný projekt. V současné době, kdy je tendence provádět výběrová řízení na jeden nejlevnější přípravek, který má pokrývat cele spektrum, jsou potřeba data, která by ukazovala rozdíly mezi jednotlivými přípravky a odborníci na jejich základě mohli usilovat o dostupnost širšího spektra léků. Jak se shodují, do budoucna by určitě pomohlo, kdyby se v rámci výběrových řízení nevybíral jen jeden nejlevnější přípravek, ale tři nebo čtyři. Pro státní nemocnice je deklarace výzkumu zcela zásadní, aby nebyly nuceny vybírat pouze tu nejlevnější anti‑TNF a anti‑IL‑17 léčbu a mohly pokračovat ve výzkumu, pro nějž mají dostatek dat.
Průběžné hodnocení dat v rámci registru ATTRA a zpětná vazba, která je takto získávána pro lékaře a zdravotnický management, splňují základní kritéria medicíny založené na důkazech. Všechna práva pacientů jsou plně zachována a centrální sběr dat probíhá anonymně, tedy bez osobních údajů. Součástí projektu je i rozsáhlý program sledování kvality života nemocných.