Progrese chronického žilního onemocnění
V minulých dvou článcích týkajících se chronického žilního onemocnění (CVD) jsme se věnovali recidivám křečových žil a některým specifickým zdrojům refluxu. V tomto textu se blíže zaměříme na faktory a procesy, které vedou k progresi CVD.
Progrese CVD je definována jako změna klinických projevů či symptomů, které ukazují na rozšíření jednotlivých klasifikačních stupňů dle klasifikace CEAP (klasifikační systém založený na klinických projevech [C], etiologických faktorech [E], anatomických poměrech [A] a základní patofyziologii [P]).1,2 Progrese CVD je velmi variabilní a u různých jedinců probíhá různými cestami. Například někteří jedinci s refluxem v rámci povrchových žil mohou být symptomatičtí, ale bez křečových žil, zatímco jiní s křečovými žilami mohou, ale nemusejí mít žádné příznaky projevů CVD.3
Mechanismy progrese CVD
Chronická žilní hypertenze a dilatace žíly vedou k řadě patofyziologických změn ve stěně žíly a okolních tkáních.4,5 Změněné smykové napětí a počáteční zánětlivé procesy na žilní stěně vedou k aktivaci endoteliálních buněk, což zvyšuje propustnost endotelu. Kromě toho abnormální hemodynamika umožňuje vstup do hry mnoha dalším faktorům, jako je hypoxie, dysregulovaná apoptóza a změny extracelulární matrix, které mohou ovlivnit vývoj varikózních žil na buněčné úrovni.6
Po extravazaci červených krvinek přes poškozený endotel a žilní stěnu dochází k jejich rozpadu. Ve tkáních se zvyšuje koncentrace fibrinu a hemosiderinu a aktivují se žírné buňky a makrofágy, které přispívají k další aktivaci endoteliálních buněk a inflamaci. Aktivovaný endotel také spouští adhezi a migraci leukocytů žilní stěnou, kde uvolňují transformující růstový faktor beta‑1 (TGF‑β1) a prozánětlivé cytokiny, které stimulují syntézu kolagenu fibroblasty, zvyšují ztluštění a remodelaci cévní stěny a potencují rozvoj zánětlivé kaskády.
Rizikové faktory, které vedou k chronické žilní hypertenzi, dilataci a následnému zánětu, vytvářejí při progresi CVD určitý začarovaný kruh patologických procesů, jež zhoršují abnormální žilní průtok. Zvyšují lokální žilní tlak, poškozují žilní chlopně a potencují zánět.7 Lokální zánět vyvolaný adhezí a infiltrací leukocytů vede ke strukturálním změnám ve stěnách žil a chlopní. Tím dochází k progresi refluxu, kapilární hypertenzi, extravazaci tekutiny a tvorbě edému.
V reálu se ukazuje, že se reflux může vyvinout i v nových lokalitách, nezávisle na již existujících postižených místech, což je v rozporu s tradičními poznatky, že primární reflux začíná na úrovni safenofemorální junkce a postupuje retrográdně. Jiné studie však již dříve ukázaly, že reflux se může vyvinout i bez postižení junkce, přičemž často narušuje různé žíly, které spolu mohou komunikovat.2,8–10 Současné poznatky podporují tato zjištění – že reflux v souvislosti s primárním CVD může retrográdním nebo antegrádním způsobem postihnout kterýkoli segment žilních systémů dolních končetin. Prodloužení žilního refluxu v průběhu času koreluje s rozvojem a rozšířením klinických projevů. Labropoulos11 prokázal, že klinické projevy u pacientů s CVD jsou závislé na prolongaci refluxu a zároveň na délce trvání onemocnění, tedy závažnost klinických projevů u CVD je závislá na čase trvání daného patologického procesu.
Rizikové faktory
Za typické základní rizikové faktory se považují pozitivní rodinná anamnéza pro CVD, ženské pohlaví, statická zátěž v rámci povolání, obezita a vícečetná parita. Panuje obecná shoda, že tyto faktory mohou významně ovlivnit rozvoj CVD.12–21 Naproti tomu význam dalších faktorů, jako je pravidelné nošení kompresních punčoch, perorální antikoncepce, zácpa, nízký příjem vlákniny, kouření, hypertenze a nízká fyzická aktivita, je považován za sporný.12,17,18,21 Existují však studie, kde dlouhodobý ortostatismus, obezita a nízká compliance při používání elastických punčoch představují nezávislé rizikové faktory, které ovlivňují progresi CVD. Naopak multiparita a léčba estrogeny nemají na progresi CVD vliv.22
Je zřejmé, že zbrzdit projevy progrese CVD lze vhodnou redukcí rizikových faktorů, nastavením správné konzervativní a intervenční léčby, která vychází z přesné diagnostiky. U pacientů s minimálními klinickými projevy CVD se vedle eliminace rizikových faktorů doporučuje nastavení konzervativní terapie. Ta spočívá v aplikaci kompresních punčoch v kombinaci s venofarmakem. Dle Labropoulose by jako venofarmakum měla být první volbou mikronizovaná purifikovaná flavonoidní frakce (MPFF). V rámci konzervativní léčby je třeba sledovat, zda je ze strany pacienta dodržován stanovený režim, zvláště aplikace kompresních punčoch. Taktéž v případě venofarmaka je nutné monitorovat jeho efektivitu. V případě výrazných symptomatických projevů CVD a při kterémkoli z klinických stadií C3–6 dle klasifikace CEAP je plně indikována intervenční terapie.23 Tato se v základu musí zaměřit na eliminaci zdrojů refluxu.
Anatomický popis popliteální oblasti
Výše jsme uváděli, že jedním z projevů progrese CVD je vícečetný zdroj refluxu. Tuto situaci si ukážeme na dvou případech v rámci povodí vena saphena parva (VSP). Tuto lokalitu volíme proto, protože se zde častěji setkáváme s minimálně dvěma zdroji proximálního refluxu. Abychom správně pochopili danou situaci, uvedeme ještě krátký anatomický popis dané oblasti.
VSP začíná u vnějšího kotníku z vena saphena lateralis a stoupá nejprve dorzolaterálně a následně dorzálně na bérci. V zákolenní jámě ústí do vena poplitea (VP). Toto napojení nazýváme safenopopliteální junkce (SPJ) a ta se vyznačuje značnou variabilitou, viz níže. Je též uložena v interfasciálním prostoru (safenózním kompartmentu). Obraz v příčném řezu distální části VSP je velmi podobný VSM, tedy „egyptskému oku“, proximálně pak nabývá tvaru trojúhelníku. Tento tvar je způsoben oběma hlavami m. gastrocnemius a fascia saphena, jež tento prostor vymezují.
Naprostá většina vyústění VSP do VP se nachází 2–4 cm proximálně od kolenní ohybové rýhy, v 25 % je to výše (proximálněji) a jen zřídka níže (distálněji). Zajímavé výsledky přinesla metaanalýza Cretona, podle níž je v případě populace bez žilního onemocnění ve 46,6 % ústí VSP výše než 7 cm od kolenní ohybové rýhy, naproti tomu u populace s insuficiencí VSP se její ústí nachází uvnitř fossa poplitea (tedy 0–7 cm) od kolenní ohybové rýhy v 57–93,7 %. Lemasle a kol. popisují stranové poměry ústí VSP: na čistě zadní straně se nachází ústí VSP v 15 % případů, dorzomediálně ve 30 %, dorzolaterálně v 12 %, laterálně v 45 % a ventrolaterálně pouze v 1 % případů. Terminální úsek VSP obdobně jako VSM obsahuje též dvě chlopně: terminální chlopeň se nachází v bezprostřední blízkosti vyústění do VP a preterminální chlopeň je obvykle v místě odstupu extensio cranialis venae saphenae parvae (ECVSP; kraniální extenze). Vyústění gastrocnemických žil do SPJ uvádějí různé studie mezi 10–30 %.24
Kraniální pokračování/extenze VSP probíhá v 95 % hluboko v těsné blízkosti fascia lata. V ultrazvukovém obraze se distální část ECVSP zobrazuje v interfasciálním prostoru trojúhelníkovitého tvaru, který se podobá právě proximálnímu kompartmentu VSP. Tento prostor je ohraničen mediálně musculus semitendinosus, laterálně musculus biceps femoris a zezadu (povrchově) fascia saphena, jež překrývá rýhu mezi svaly.24
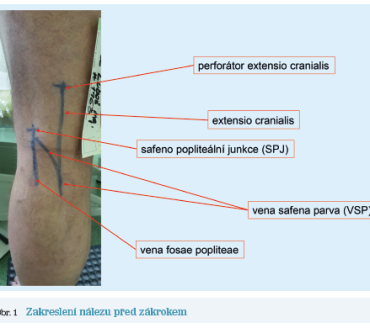 V klinice má znalost těchto anatomických poměrů význam především při odhalení zdroje refluxu, protože se tak může přenášet reflux z perianálních žil, proximálních stehenních perforátorů, VSM, resp. ze SPJ do VSP. Ve spojitosti s ECVSP bývá někdy popisován tzv. „obrácený výstupní reflux“ ze SPJ do VSM nebo varixů zadní strany stehna.24
V klinice má znalost těchto anatomických poměrů význam především při odhalení zdroje refluxu, protože se tak může přenášet reflux z perianálních žil, proximálních stehenních perforátorů, VSM, resp. ze SPJ do VSP. Ve spojitosti s ECVSP bývá někdy popisován tzv. „obrácený výstupní reflux“ ze SPJ do VSM nebo varixů zadní strany stehna.24
Je třeba rovněž připomenout vena fossa poplitea, která probíhá v podkoží po zadní straně lýtka, mnohdy souběžně s VSP, a ústí samostatně do VP, většinou laterálně od VSP.24
První kazuistika
 Prvním příkladem je muž narozený v roce 1963, který měl symptomatické retikulární varikozity dorzální strany bérce. Na základě pouhého klinického vyšetření by se mohlo zdát, že udávané potíže v podobě bolesti, tíže, intermitentních perimaleolárních otoků nejsou primárně vyvolány žilní nedostatečností. Nález by byl dle klasifikace CEAP hodnocen jako C1‑2 Ep As Pr. Po podrobném mappingu povrchového žilního systému však byla diagnostikována insuficience SPJ, odkud byl reflux distribuován do VSP, zde dosahoval až k laterálnímu kotníku. Se SPJ komunikovala též vena fossa poplitea, která proximálně probíhala souběžně s VSP a v proximální třetině bérce opustila svůj kompartment a rozpadla se ve více epifasciálních přítoků, v jejichž rámci se pak též tvořily retikulární varikozity. Jako další zdroj refluxu byl diagnostikován insuficientní perforátor v rámci extensio cranialis, které ve fossa poplitea ústilo do VSP a podílelo se na progresi její insuficience (obr. 1). Navíc v rámci doplňkového pletysmografického testu (venous reflux testing, VRT) byl diagnostikován reflux ve svalových žilách bérce s kapilárním návratem (capillary refill time, CRT) 5 sekund, což je známka významně snížené funkce svalově‑žilní pumpy. Díky tomuto nálezu byl nález dle klasifikace CEAP vyhodnocen jako C1,2s,3 Ep As,d,p Pr. Takovýto nález jednoznačně splňuje podmínky pro indikaci intervenčního řešení.
Prvním příkladem je muž narozený v roce 1963, který měl symptomatické retikulární varikozity dorzální strany bérce. Na základě pouhého klinického vyšetření by se mohlo zdát, že udávané potíže v podobě bolesti, tíže, intermitentních perimaleolárních otoků nejsou primárně vyvolány žilní nedostatečností. Nález by byl dle klasifikace CEAP hodnocen jako C1‑2 Ep As Pr. Po podrobném mappingu povrchového žilního systému však byla diagnostikována insuficience SPJ, odkud byl reflux distribuován do VSP, zde dosahoval až k laterálnímu kotníku. Se SPJ komunikovala též vena fossa poplitea, která proximálně probíhala souběžně s VSP a v proximální třetině bérce opustila svůj kompartment a rozpadla se ve více epifasciálních přítoků, v jejichž rámci se pak též tvořily retikulární varikozity. Jako další zdroj refluxu byl diagnostikován insuficientní perforátor v rámci extensio cranialis, které ve fossa poplitea ústilo do VSP a podílelo se na progresi její insuficience (obr. 1). Navíc v rámci doplňkového pletysmografického testu (venous reflux testing, VRT) byl diagnostikován reflux ve svalových žilách bérce s kapilárním návratem (capillary refill time, CRT) 5 sekund, což je známka významně snížené funkce svalově‑žilní pumpy. Díky tomuto nálezu byl nález dle klasifikace CEAP vyhodnocen jako C1,2s,3 Ep As,d,p Pr. Takovýto nález jednoznačně splňuje podmínky pro indikaci intervenčního řešení.
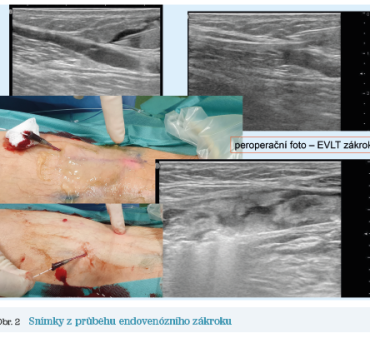
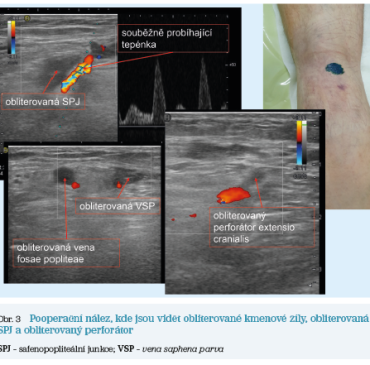 Daný jedinec se rozhodl pro řešení pomocí endovenózního zákroku. Snímky z jeho realizace ukazuje obrázek 2, pooperační nález pak obrázek 3.
Daný jedinec se rozhodl pro řešení pomocí endovenózního zákroku. Snímky z jeho realizace ukazuje obrázek 2, pooperační nález pak obrázek 3.
Zákrok byl realizován ambulantní formou v lokální tumescenční anestezii, v období po zákroku mohl pacient absolvovat běžný denní režim zcela bez omezení. Od druhého týdne přestal vnímat symptomy spojené s varikozitami a otoky se přestaly tvořit. Též CRT se po měsíci prodloužil na 23 sekund. Takže dle klasifikace CEAP mohl být nález měsíc po zákroku hodnocen jako C0 Ep Ad Pr.
Druhá kazuistika
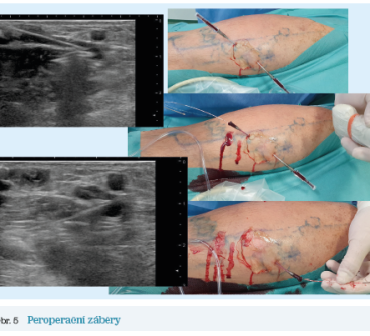
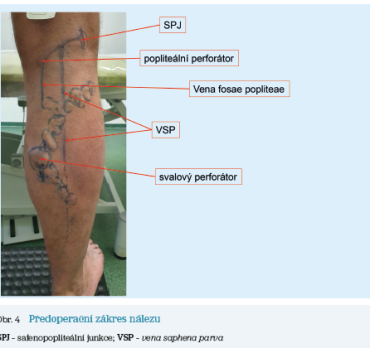 Druhým příkladem je též muž, který již v době diagnostiky měl počínající kožní změny distálního bérce z mediální strany v podobě drobných pigmentací, otoky byly přítomny perimaleolárně jak u mediálního, tak u laterálního kotníku. Varixy byly poměrně výrazné. Po mappingu na základě duplexní ultrasonografie byl diagnostikován reflux z vlastní SPJ, která se nacházela opět poměrně laterálně v rámci fossa poplitea, z této se distribuoval reflux do VSP a též do vena fossa poplitea. Ta měla též drenáž v popliteálním perforátoru, který však byl štíhlý a suficientní. Dalším zdrojem refluxu byl insuficientní a výrazně dilatovaný (4,7 mm ve vertikální poloze) svalový perforátor. Tento byl zdrojem refluxu jak do varikozit dorzální strany bérce, tak do intersafenózní spojky, která byla spojena s refluxem, ale bez varikózních změn (obr. 4). I zde byla diagnostikována snížená funkce svalově‑žilní pumpy, CRT 6 sekund. Dle klasifikace CEAP byl nález hodnocen jako C1,2s,3,4a Ep As,d,p Pr. Takovýto nález je též jednoznačnou indikací k intervenčnímu řešení. Daný jedinec rovněž volil endovenózní postup (obr. 5), který byl též realizován ambulantní formou s bezprostředním návratem do normální pracovní zátěže.
Druhým příkladem je též muž, který již v době diagnostiky měl počínající kožní změny distálního bérce z mediální strany v podobě drobných pigmentací, otoky byly přítomny perimaleolárně jak u mediálního, tak u laterálního kotníku. Varixy byly poměrně výrazné. Po mappingu na základě duplexní ultrasonografie byl diagnostikován reflux z vlastní SPJ, která se nacházela opět poměrně laterálně v rámci fossa poplitea, z této se distribuoval reflux do VSP a též do vena fossa poplitea. Ta měla též drenáž v popliteálním perforátoru, který však byl štíhlý a suficientní. Dalším zdrojem refluxu byl insuficientní a výrazně dilatovaný (4,7 mm ve vertikální poloze) svalový perforátor. Tento byl zdrojem refluxu jak do varikozit dorzální strany bérce, tak do intersafenózní spojky, která byla spojena s refluxem, ale bez varikózních změn (obr. 4). I zde byla diagnostikována snížená funkce svalově‑žilní pumpy, CRT 6 sekund. Dle klasifikace CEAP byl nález hodnocen jako C1,2s,3,4a Ep As,d,p Pr. Takovýto nález je též jednoznačnou indikací k intervenčnímu řešení. Daný jedinec rovněž volil endovenózní postup (obr. 5), který byl též realizován ambulantní formou s bezprostředním návratem do normální pracovní zátěže.
 Nález měsíc po operaci byl také výrazně redukován a jeho zápis dle klasifikace CEAP byl: C1,4a Ep As,d Pr. Což lze popsat tak, že v rámci povrchových žil zůstal reflux jen na úrovni teleangiektazií, hemosiderinové pigmentace přetrvávaly, otoky však odezněly a odezněly též symptomy CVD. Přetrvával reflux v rámci svalových žil, ačkoliv došlo k prolongaci CRT z šesti na 18 sekund. V rámci druhé kazuistiky je ještě nutno zdůraznit moment refluxu do intersafenózní spojky, protože zde se reflux přenáší z povodí VSP do povodí vena saphena magna (VSM) a ovlivňuje tak rozvoj CVD z mediální strany bérce. Toto nesmí být nikdy opomenuto. Dle kliniky mohly pigmentace u mediálního kotníku a otok též u mediálního kotníku evokovat, že se jedná o reflux v rámci povodí VSM. Ta však byla suficientní, a naopak v případě nálezu refluxu v rámci VSP se nelze soustředit jen na její průběh.
Nález měsíc po operaci byl také výrazně redukován a jeho zápis dle klasifikace CEAP byl: C1,4a Ep As,d Pr. Což lze popsat tak, že v rámci povrchových žil zůstal reflux jen na úrovni teleangiektazií, hemosiderinové pigmentace přetrvávaly, otoky však odezněly a odezněly též symptomy CVD. Přetrvával reflux v rámci svalových žil, ačkoliv došlo k prolongaci CRT z šesti na 18 sekund. V rámci druhé kazuistiky je ještě nutno zdůraznit moment refluxu do intersafenózní spojky, protože zde se reflux přenáší z povodí VSP do povodí vena saphena magna (VSM) a ovlivňuje tak rozvoj CVD z mediální strany bérce. Toto nesmí být nikdy opomenuto. Dle kliniky mohly pigmentace u mediálního kotníku a otok též u mediálního kotníku evokovat, že se jedná o reflux v rámci povodí VSM. Ta však byla suficientní, a naopak v případě nálezu refluxu v rámci VSP se nelze soustředit jen na její průběh.
Pouze přesné zmapování všech zdrojů refluxu a jejich důsledná eliminace mohou minimalizovat progresi rozvoje CVD.
MUDr. Lukáš Hnátek, Ph.D.
AngioCor – Centrum žilních onemocnění, Zlín
E‑mail: hnatek.lukas@gmail.com
Literatura
- Eklof B, Rutherford RB, Bergan JJ, et al. Revision of the CEAP classification for chronic venous disorders: consensus statement. J Vasc Surg 2004;40:1248–1252. (Epub 2004/12/29)
- Lee AJ, Robertson LA, Boghossian SM, et al. Progression of varicose veins and chronic venous insufficiency in the general population in the Edinburgh Vein Study. J Vasc Surg Venous Lymphat Disord 2015;3:18–26 (Epub 2015/01/01)
- Labropoulos N, Leon L, Kwon S, et al. Study of the venous reflux progression. J Vasc Surg 2005;41:291–295. (Epub 2005/03/16)
- Bergan J. Molecular mechanisms in chronic venous insufficiency. Ann Vasc Surg 2007;21:260–266. (Epub 2007/05/09)
- Castro‑Ferreira R, Cardoso R, Leite‑Moreira A, Mansilha A. The role of endothelial dysfunction and inflammation in chronic venous disease. Ann Vasc Surg 2018;46:380–393. (Epub 2017/07/10)
- Jacobs BN, Andraska EA, Obi AT, Wakefield TW. Pathophysiology of varicose veins. J Vasc Surg Venous Lymphat Disord 2017;5:460–467. (Epub 2017/04/17)
- Bergan JJ, Schmid‑Schonbein GW, Smith PD, et al. Chronic venous disease. N Engl J Med 2006;355:488–498. (Epub 2006/08/04)
- Labropoulos N, Giannoukas AD, Delis K, et al. Where does venous reflux start? J Vasc Surg 1997;26:736–742.
- Katsamouris AN, Kardoulas DG, Gourtsogiannis N. The nature of lower extremity venous insufficiency in patients with primary varicose veins. Eur J Vasc Surg 1994;8:464–471.
- Labropoulos N, Delis KT, Nicolaides AN. Venous reflux in symptomfree vascular surgeons. J Vasc Surg 1995;22:150–154.
- Labropoulos N, Delis K, Nicolaides AN, et al. The role of the distribution and anatomic extent of reflux in the development of signs and symptoms in chronic venous insufficiency. J Vasc Surg 1996;23:504–510.
- Beebe‑Dimmer JL, Pfeifer JR, Engle JS, Schottenfeld D. The epidemiology of chronic venous insufficiency and varicose veins. Ann Epidemiol 2005;15:175–184.
- Seidell JC, Bakx KC, Deurenberg P, et al. Overweight and chronic illness—a retrospective cohort study, with a follow‑up of 6‑17 years, in men and women of initially 20‑50 years of age. J Chronic Dis 1986;39:585–593.
- Laurikka JO, Sisto T, Tarkka MR, et al. Risk indicators for varicose veins in forty‑ to sixty‑year‑olds in the Tampere varicose vein study. World J Surg 2002;26:648–651.
- Gourgou S, Dedieu F, Sancho‑Garnier H. Lower limb venous insufficiency and tobacco smoking: a case‑control study. Am J Epidemiol 2002;155:1007–1015.
- Brand FN, Dannenberg AL, Abbott RD, Kannel WB. The epidemiology of varicose veins: the Framingham Study. Am J Prev Med 1988;4: 96–101.
- Fowkes FG, Lee AJ, Evans CJ, et al. Lifestyle risk factors for lower limb venous reflux in the general population: Edinburgh Vein Study. Int J Epidemiol 2000;30:846–852.
- Sisto T, Reunanen A, Laurikka J, et al. Prevalence and risk factors of varicose veins in lower extremities: mini‑Finland health survey. Eur J Surg 1995;161: 405–414.
- Jawien A. The influence of environmental factors in chronic venous insufficiency. Angiology 2003;54(suppl 1):S19–31.
- Dindelli M, Parazzini F, Basellini A, et al. Overweight and chronic illness—a retrospective cohort study, with a follow‑up of 6‑17 years, in men and women of initially 20‑50 years of age. J Chronic Dis 1986;39:585–593.
- Vin F, Allaert FA, Levardon M. Influence of estrogens and progesterone on the venous system of the lower limbs in women. J Dermatol Surg Oncol 1992;8:888–892.
- Kostas TI, Ioannou CV, Drygiannakis I, et al. Chronic venous disease progression and modification of predisposing factors. J Vasc Surg 2010;51:900–907. doi: 10.1016/j.jvs.2009.10.119.
- Palfreyman SJ, Michaels JA. A systematic review of compression hosiery for uncomplicated varicose veins. Phlebology 2009;24(Suppl 1):13–33. (Epub 2009/05/16)
- Hnátková G, Hnátek L, Kachlík D. Duplexní ultrasonografie povrchového žilního systému. Prakt flebol 2022;1–4:16–28.