Přínos umělé inteligence v diagnostice karcinomu pankreatu
Umělá inteligence se v gastroenterologii a digestivní endoskopii využívá ve stále větší míře. V případě karcinomu pankreatu může mít potenciální přínos v urychlení stanovení diagnózy, zhodnocení a predikci efektivity léčebných metod a vytvoření rizikových skupin, u kterých bude mít cílený screeningový program největší přínos. Karcinom pankreatu je maligním onemocněním s nepříznivou prognózou a obecně krátkou dobou přežití. Zachycení karcinomu pankreatu v časném stadiu výrazně zvyšuje šanci nemocného na úspěšné vyléčení či alespoň významné prodloužení délky přežití. Pokrok ve využití umělé inteligence v klinické medicíně může mít zásadní vliv na budoucnost našeho přístupu ke karcinomu pankreatu. Vytvoření spolehlivých modelů umělé inteligence bude vyžadovat vytvoření co největších databází klinických případů s obrazovou dokumentací, laboratorními hodnotami a léčebnými postupy, ze kterých se umělá inteligence bude spolehlivě učit. V budoucnosti diagnostiky a léčby karcinomu pankreatu bude mít umělá inteligence jistě velký vliv, při jejím využití však budeme muset brát v potaz její limitace.
Úvod
Karcinom slinivky břišní je agresivním maligním onemocněním. Typicky se manifestuje až v pozdním stadiu a prognóza nemocných je nepříznivá. Většina pacientů je tak diagnostikována již s metastatickým postižením či s lokálně pokročilým nálezem a dlouhodobé přežití je u nich velmi vzácné. Pětileté přežití se pohybuje v rozmezí 2–9 %.1 Včasná diagnostika karcinomu pankreatu je svízelná, ale časná stadia onemocnění jsou spjata s možností léčby kombinací chirurgie, chemoterapie a radioterapie a s lepším výsledkem terapeutických postupů. Screeningový program pro širokou populaci zatím není z různých důvodů doporučován a je snaha definovat vysoce rizikové skupiny s kumulativním rizikem vyšším než 5 %, u kterých by měl program časného záchytu největší význam, jako jsou například pacienti s určitými syndromy a diagnózami (například Peutzův–Jeghersův syndrom, hereditární karcinom prsu či ovaria, Lynchův syndrom, hereditární pankreatitida).2 Pro časná stadia karcinomu pankreatu neexistuje dostatečně spolehlivý biomarker. Nejlépe prozkoumaným onkomarkerem karcinomu pankreatu je CA 19‑9, který je v časných stadiích onemocnění nepřesný. K jeho spolehlivému zvýšení dochází až u pokročilých stadií a je vhodnější k monitoraci onemocnění onkologem.3 Radiologické zobrazovací metody jako výpočetní tomografie (CT) a magnetická rezonance (MR) jsou základními technikami k detekci karcinomu pankreatu.4 Z endoskopických metod zde má pak nezastupitelnou pozici endosonografie (EUS), která umožňuje odběr bioptického materiálu k histologické či cytologické verifikaci ložiska.5 Další metody, jako kontrastní EUS či pozitronová emisní tomografie (PET), mohou dále diagnostiku karcinomu pankreatu zpřesnit. S rozvojem umělé inteligence (Artificial Inteligence – AI) se otevírají nové perspektivy pro lepší pochopení rizikových faktorů, včasnou detekci, léčbu a sledování tohoto maligního onemocnění. Tento pokrok by mohl vést k časnějšímu zachycení karcinomu pankreatu a k prodloužení délky přežívání nemocných.
Přínos umělé inteligence
Využití umělé inteligence v gastroenterologii se velmi rychle vyvíjí. Nejvíce prozkoumanou problematikou je detekce neoplastických lézí tlustého střeva, ovšem pozornost je věnována také karcinomu pankreatu. AI se zaměřuje na hodnocení obrazové dokumentace z CT, MR i EUS, ale také na hodnocení a pochopení rizikových faktorů. K vytvoření spolehlivých modelů k hodnocení predikčních hodnot rizikových faktorů je potřeba správná metoda strojového učení (machine learning – ML). Vhodnou podkategorií ML jsou tak metody hlubokého učení (deep learning – DL). DL dokáže efektivně zpracovávat velké objemy dat a hodnotit proměnné. AI se tak vyznačuje větší flexibilitou, schopností hodnotit v jednom okamžiku větší množství proměnných a chápat komplexní vztahy mezi nimi. AI vykonává svoji práci konzistentně a neúnavně. Mezi první vyšetření, která pacient s podezřením na karcinom slinivky podstupuje, je CT. AI může CT diagnostiku zlepšit mnoha způsoby. Patří sem zachycení ložiska, zlepšení diferenciální diagnostiky a automatický staging a posouzení potencionální resekability. Při hodnocení ML modelů se kromě přesnosti, senzitivity, specificity, negativní a pozitivní prediktivní hodnoty využívá ROC křivka (z anglického receiver operating characteristics). Jedná se o graf vizualizující přesnost těchto modelů. Plocha pod ROC křivkou (AUC – area under curve) je vyhodnocovací metrika. Čím je tato plocha větší, tím lépe si vedly algoritmy daného ML modelu. AUC se vyjadřuje v hodnotách 0 až 1. Modely, jejichž predikce byly ve 100 % případů špatné, mají hodnotu 0. Naopak modely, jejichž predikce byly ve 100 % případů správné, mají hodnotu 1. Čím vyšší hodnota AUC, tím lépe si ML model v dané problematice vedl.6
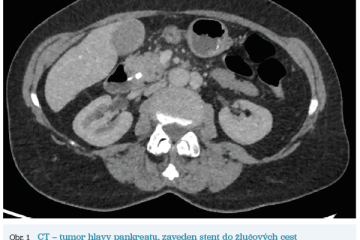
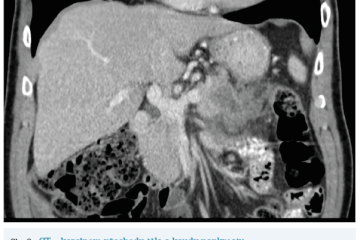
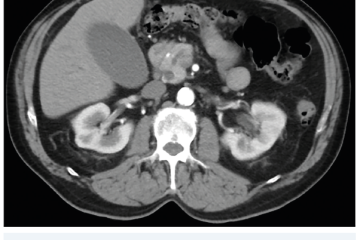
Několik studií se zabývalo AI asistovanou CT detekcí karcinomu pankreatu s AUC 0,79–0,99 %,6–8 tedy přesností porovnatelnou s přesností práce zkušeného radiologa. Stran časné detekce proběhla studie posuzující přesnost AI modelu v detekci karcinomu pankreatu v období 3–36 měsíců před prvními projevy onemocnění. Zařazeno bylo 155 pacientů s karcinomem pankreatu a 265 zdravých kontrol. AI model zde dosáhl AUC 0,98, což výrazně předčilo radiology, kteří při popisování stejných případů dosáhli AUC 0,66.9 Studie využívající DL model pro rozlišení zdravé slinivky od nálezu pankreatických neoplazií, tedy karcinomu pankreatu, intraduktální papilární mucinózní neoplazie (IPMN), serózních a mucinózních cystických neoplazií a solidní pseudopapilární neoplazie, byla prezentována s AUC 0,91, tedy opět odpovídající přesnosti popisu radiologa.10 Pro další vývoj a možné klinické využití bude potřeba přístupu k rozsáhlému archivu CT snímků karcinomu pankreatu, aby se ML modely mohly zdokonalovat. Další studie se věnovaly AI asistované diferenciální diagnostice. Ta bývá u lézí pankreatu velmi obtížná a pokrok v této problematice je tak velmi přínosný. Mezi nejzajímavější patří studie zabývající se rozlišením serózních a mucinózních cystadenomů s AUC 0,932.11 Další studie zkoumala úspěšnost rozlišení karcinomu pankreatu od zbytnění pankreatu při určitých formách chronické pankreatitidy (MFP – mass forming pancreatitis) s AUC 0,866.12 V další studii byla AI využita k rozlišení fokální autoimunitní pankreatitidy od karcinomu pankreatu s AUC 0,97.13 V rámci MR proběhlo několik studií, které se zaměřily na AI asistované zachycení a klasifikaci pankreatického karcinomu či IPMN. Studie klasifikující IPMN pomocí konvoluční neuronové sítě (CNN – convolutional neural network) byla schopna rozlišit dysplazii vysokého stupně od přítomnosti karcinomu se senzitivitou 76 %, specificitou 78 % a AUC 0,78.14 Další studie porovnávala AI modely CT a MR v predikci maligního IPMN. Výsledky ukázaly, že MR model s AUC 0,94 byl přesnější než CT model s AUC 0,864.15 S využitím PET/CT byl prozkoumán AI model rozlišující od sebe akutní pankreatitidu a karcinom pankreatu s AUC 0,9668.16 Výsledky AI v oblastech zobrazovacích metod jsou tak slibné. Dosahují minimálně přesnosti srovnatelné s radiologem a zejména v problematice časných karcinomů pankreatu člověka svojí přesností převyšují (obr. 1–5).
Biomarkery hrají u maligních onemocnění velmi důležitou roli ve screeningu, diagnostice i léčbě. U karcinomu pankreatu bohužel není dostatečně senzitivní biomarker, který by v klinické praxi mohl sloužit ke screeningu.3 Určitou budoucnost pak nabízí AI asistované zhodnocení aspiračního materiálu získaného pod endosonografickou kontrolou. Získaný materiál, obsahující proteiny, exozomy a volnou cirkulující DNA (cf DNA – cell free DNA), již byl ve studiích použit k úspěšnému stanovení diagnózy karcinomu pankreatu.17,18 Některé studie poukazují na dysregulaci metabolismu lipidů v nádorových buňkách, které se mohou projevit v krevním lipidomu. Ukázalo se, že komplexní spektrometrické stanovení širokého spektra lipidů poukazuje na statisticky významné rozdíly mezi zdravou populací a pacienty s karcinomem pankreatu. Senzitivita a specificita této diagnostické metody přesahují 90 %, což je srovnatelné se zobrazovacími metodami a zcela převyšuje přínos onkomarkeru CA 19‑9, zejména v časných stadiích.29 Další výzkum této problematiky by mohl vést k časné diagnostice karcinomu pankreatu založené na biomarkerech.19,20
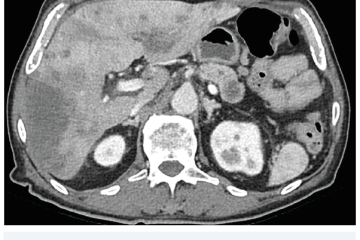
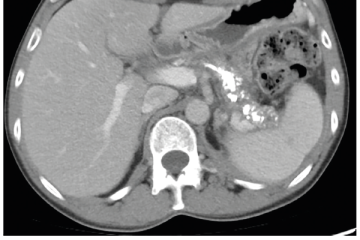
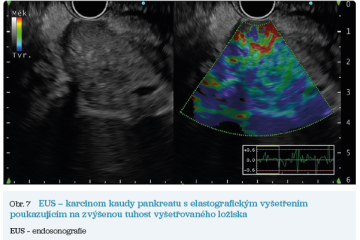
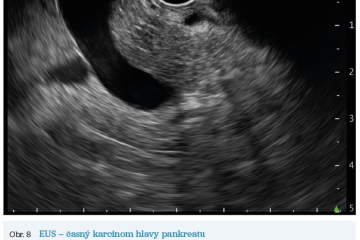
EUS umožňuje přesné vyšetření pankreatu. Lze také identifikovat a vyšetřit regionální lymfatické uzliny a vztah pankreatických lézí k okolním cévním strukturám. EUS může také sloužit jako navigace k odběru bioptického materiálu k cytologickému a histologickému vyšetření.21 AI je zde využívána k potvrzení malignity v IPMN. Kuwahara a kol. dosáhli s využitím 3 970 snímků a CNN algoritmu velké úspěšnosti v diferenciaci benigní a maligní IPMN s AUC 0,98.22 Řada studií se již zabývala AI asistovaným rozlišením chronické pankreatitidy a karcinomu pankreatu s AUC 0,940–0,986.23,24 Velká studie obsahující 1 174 461 snímků z celkem 583 případů hodnotící rozlišení autoimunitní pankreatitidy, karcinomu pankreatu, chronické pankreatitidy a normálního pankreatu dosáhla pro karcinom pankreatu AUC 0,97625 (obr. 6–9).
Predikce efektivity terapeutických postupů je velmi komplexní a náročná problematika. Vzhledem ke skutečnosti, že 80–85 % pacientů s karcinomem pankreatu je diagnostikováno v inoperabilním stadiu, je potřeba vyvinout AI moduly, které by správně predikovaly efektivitu léčebných modalit pro tyto pacienty. Tyto moduly by mohly klinikovi pomoci vybrat nejlepší terapeutický postup, který by pacientovi zajistil nejlepší možný výsledek ve vztahu k pokročilosti jeho onemocnění. Přesto probíhají studie zaměřené dominantně na predikci efektivity operačního řešení. To se týká pouze minority pacientů s karcinomem pankreatu, ovšem operace představuje jedinou reálnou šanci na úspěšné vyléčení pacienta a skutečně dlouhodobé přežití. Studie založená na DL modelu hodnotícím předoperační snímky u 296 pacientů dosáhla C‑indexu (obecné vyjádření AUC, obdobně hodnocení v rozmezí 0–1) o hodnotě 0,667.26 Ukazuje se tak, že předoperační snímky samotné nemusejí být k predikci prognózy pacienta dostatečné. K vytvoření přesného predikčního modelu bude potřeba do hodnocení zakomponovat další klinická i paraklinická data. Léčení pacienti jsou standardně sledováni a odpověď na léčbu je u nich pravidelně kontrolována. Pro hodnocení efektivity léčby a rozhodování o dalším postupu jsou zásadní snímky z pravidelných kontrolních CT vyšetření. Hodnocení může být obtížné, neboť léčba může vést k zánětlivým a nekrotickým změnám, které mohou být na snímcích obtížně odlišitelné od eventuální progrese či rekurence nádoru.27 AI výzkum v problematice monitoringu léčených pacientů s karcinomem pankreatu je oproti jiným oblastem spíše pozadu. K vytvoření modelu s přesným hodnocením odpovědi na léčbu bude potřeba zajištění velkého objemu dat, aby se AI model mohl naučit terapeutickou odpověď bezpečně určit. Zatím proběhla studie hodnotící odpověď na neoadjuvantní chemoterapii u 90 pacientů, která je rozdělila na dobré a špatné respondéry. V nezávislém testu na 40 pacientech tento AI model dosáhl AUC 0,9828 a dokázal tak velmi přesně určit efekt léčby. Další výzkum v této oblasti, včetně modelů pro dlouhodobé sledování pacientů po léčbě karcinomu pankreatu, bude zajisté přínosný.
Závěr
Vzhledem k výrazným pokrokům na poli hlubokého učení a zpracovávání dat získává AI možnost vést k transformaci klinické medicíny, jak ji známe. K lepší spolehlivosti AI také vede nárůst dostupných klinických dat, ze kterých se může učit. V rámci karcinomu slinivky břišní se další pokrok AI bude patrně zabývat časnou diagnostikou a predikcí nejefektivnějšího terapeutického postupu. Velký přínos se očekává zejména od hodnocení snímků zobrazovacích metod. Zde má velký vliv kvalita snímků a přítomnost abnormalit či jiných faktorů (například zavedených biliárních stentů), které mohou vést k nesprávným výsledkům. S nárůstem poznatků o karcinomu pankreatu bude zcela jistě růst i množství klinických dat a proměnných, proto i AI modely budou muset být vyvíjeny tak, aby zvládaly vyhodnocovat komplexní problematiku. Vzhledem k pokroku a mezioborové spolupráci bude AI zajisté velmi významným pomocníkem lékařů. Navzdory všem obtížím se tak AI patrně bude využívat ve všech aspektech problematiky karcinomu pankreatu (časná diagnostika, vymezení rizikových skupin, prognostický odhad, výběr nejlepšího terapeutického postupu, hodnocení efektu léčby).
MUDr. Tomáš Tichý,
doc. MUDr. Přemysl Falt, Ph.D., MHA,
prof. MUDr. Ondřej Urban, Ph.D.
II. interní klinika gastroenterologickáa geriatrická, LF UP a FN Olomouc
Korespondenční adresa:tomas.tichy2@fnol.cz
Literatura
- McGuigan A, Kelly P, Turkington RC, et al. Pancreatic cancer: a review of clinical diagnosis, epidemiology, treatment and outcomes. World J Gastroenterol 2018;24:4846–4861. doi: 10.3748/wjg.v24.i43.4846
- Vanek P, Slodicka P, Zoundjiekpon V, et al. Pancreatic cancer screening: ready for prime time? Gastroent Hepatol 2021;75:390–398. doi: 10.48095/ccgh2021390
- Force UPST. Screening for Pancreatic Cancer: US Preventive Services Task Force Reaffirmation Recommendation Statement. Jama‑J Am Med Assoc 2019;322:438–444. doi: 10.1001/jama.2019.10232
- Lee ES, Lee JM. Imaging diagnosis of pancreatic cancer: a state‑of‑the‑art review. World J Gastroenterol 2014;20:7864–7877. doi: 10.3748/wjg.v20.i24.7864
- Kitano M, Yoshida T, Itonaga M, et al. Impact of endoscopic ultrasonography on diagnosis of pancreatic cancer. J Gastroenterol 2019;54:19–32. doi:10.1007/s00535‑018‑1519‑2
- Ma H, Liu ZX, Zhang JJ, et al. Construction of a convolutional neural network classifier developed by computed tomography images for pancreatic cancer diagnosis. World J Gastroenterol 2020;26:5156–5168. doi 10.3748/wjg.v26.i34.5156
- Ebrahimian S, Singh R, Netaji A, et al. Characterization of Benign and Malignant Pancreatic Lesions with DECT Quantitative Metrics and Radiomics. Acad Radiol 2022;29:705–713. doi:10.1016/j.acra.2021.07.008
- Chu LC, Park S, Kawamoto S, et al. Utility of CT Radiomics Features in Differentiation of Pancreatic Ductal Adenocarcinoma From Normal Pancreatic Tissue. Am J Roentgenol 2019;213:349–357. doi: 10.2214/AJR.18.20901
- Mukherjee S, Patra A, Khasawneh H, et al. Radiomicsbased machine‑learning models can detect pancreatic cancer on prediagnostic computed tomography scans at a substantial lead time before clinical diagnosis. Gastroenterology 2022;163:1435–1446.e3. doi:10.1053/j.gastro.2022.06.066
- Park HJ, Shin K, You MW, et al. Deep learning‑based detection of solid and cystic pancreatic neoplasms at contrast‑enhanced CT. Radiology 2023;306:140–149. doi: 10.1148/radiol.220171
- Chen HY, Deng XY, Pan Y, et al. Pancreatic Serous Cystic Neoplasms and Mucinous Cystic Neoplasms: Differential Diagnosis by Combining Imaging Features and Enhanced CT Texture Analysis. Front Oncol 2021;11:745001. doi: 10.3389/fonc.2021.745001
- Ikeda M, Ito S, Ishigaki T, Yamauchi K. Evaluation of a neural network classifier for pancreatic masses based on CT findings. Comput Med Imag Grap 1997;21:175–183.doi: 10.1016/s0895‑6111(97)00006‑2
- Li J, Liu F, Fang X, et al. CT Radiomics Features in Differentiation of Focal‑Type Autoimmune Pancreatitis from Pancreatic Ductal Adenocarcinoma: A Propensity Score Analysis. Acad Radiol 2022;29:358–366. doi: 10.1016/j.acra.2021.04.014
- Corral JE, Hussein S, Kandel P, et al. Deep Learning to Classify Intraductal Papillary Mucinous Neoplasms Using Magnetic Resonance Imaging. Pancreas 2019;48:805–810. 152. doi: 10.1097/MPA.0000000000001327
- Cheng S, Shi H, Lu M, et al. Radiomics Analysis for Predicting Malignant Potential of Intraductal Papillary Mucinous Neoplasms of the Pancreas: Comparison of CT and MRI. Acad Radiol 2022;29:367–375. doi: 10.1016/j.acra.2021.04.013
- Liu Z, Li M, Zuo C, et al. Radiomics model of dual‑time 2‑[(18)F]FDG PET/CT imaging to distinguish between pancreatic ductal adenocarcinoma and autoimmune pancreatitis. Eur Radiol 2021;31:6983–6991. doi: 10.1007/s00330‑021‑07778‑0
- Cristiano S, Leal A, Phallen J, et al. Genome‑wide cell‑free DNA fragmentation in patients with cancer. Nature 2019;570:385–389. doi: 10.1038/s41586‑019‑1272‑6
- Chen C, Zong S, Liu Y, et al. Profiling of Exosomal Biomarkers for Accurate Cancer Identification: Combining DNA‑PAINT with Machine‑Learning‑Based Classification. Small 2019;15:e1901014. doi: 10.1002/smll.201901014
- Bhinder B, Gilvary C, Madhukar NS, Elemento O. Artificial Intelligence in Cancer Research and Precision Medicine. Cancer Discov 2021;11:900–915. doi: 10.1158/2159‑8290.CD‑21‑0090
- Yang J, Xu R, Wang C, et al. Early screening and diagnosis strategies of pancreatic cancer: a comprehensive review. Cancer Commun 2021;41:1257–1274. doi: 10.1002/cac2.12204
- Moutinho‑Ribeiro P, Iglesias‑Garcia J, Gaspar R, Macedo G. Early pancreatic cancer – The role of endoscopic ultrasound with or without tissue acquisition in diagnosis and staging. Digest Liver Dis 2019;51:4–9. doi: 10.1016/j.dld.2018.09.027
- Kuwahara T, Hara K, Mizuno N, et al. Usefulness of Deep Learning Analysis for the Diagnosis of Malignancy in Intraductal Papillary Mucinous Neoplasms of the Pancreas. Clin Transl Gastroen 2019;10:1–8. doi: 10.14309/ctg.0000000000000045
- Tonozuka R, Itoi T, Nagata N, et al. Deep learning analysis for the detection of pancreatic cancer on endosonographic images: a pilot study. J Hepato‑Bil‑Pan Sci 2021;28:95–104. doi: 10.1002/jhbp.825
- Tong T, Gu J, Xu D, et al. Deep learning radiomics based on contrast‑enhanced ultrasound images for assisted diagnosis of pancreatic ductal adenocarcinoma and chronic pancreatitis. BMC Med 2022;20:74. doi: 10.1186/s12916‑022‑02258‑8
- Marya NB, Powers PD, Chari ST, et al. Utilisation of artificial intelligence for the development of an EUS‑convolutional neural network model trained to enhance the diagnosis of autoimmune pancreatitis. Gut 2021;70:1335–1344. doi: 10.1136/gutjnl‑2020‑322821
- Yao J, Shi Y, Cao K, et al. DeepPrognosis: preoperative prediction of pancreatic cancer survival and surgical margin via comprehensive understanding of dynamic contrast‑enhanced CT imaging and tumor‑vascular contact parsing. Med Image Anal 2021;73:102150. doi: 10.1016/j.media.2021.102150
- Baliyan V, Kordbacheh H, Parakh A, et al. Response assessment in pancreatic ductal adenocarcinoma: role of imaging. Abdom Radiol 2018;43:435–444. doi: 10.1007/s00261‑017‑1434‑7
- Nasief H, Zheng C, Schott D, et al. A machine learning based delta‑radiomics process for early prediction of treatment response of pancreatic cancer. NPJ Precis Oncol 2019;3:25. doi: 10.1038/s41698‑019‑0096‑z
- Wolrab D, Jirásko R, Cífková E, et al. Lipidomic profiling of human serum enables detection of pancreatic cancer. Nat Commun 2022;13:124. doi:10.1038/s41467‑021‑27765‑9 OPE