Paroxysmální noční hemoglobinurie – úvod do problematiky
Paroxysmální noční hemoglobunurie je vzácné získané onemocnění, které je podmíněno klonální expanzí kmenové buňky a spojeno s dysregulací komplementového systému. Mezi hlavní rysy onemocnění patří hemolýza, různý stupeň insuficience kostní dřeně, vysoké riziko rozvoje trombotických komplikací; klinické projevy zahrnují vedle příznaků anémie pestrou škálu symptomů spojených s orgánovou dysfunkcí.
Paroxysmální noční hemoglobinurie (PNH) se může vyskytovat jako tzv. klasická forma s charakteristickou hemolýzou (nejčastější), probíhající jako chronická hemolýza s akutními atakami, hypoplastická forma s převažujícími rysy selhávání kostní dřeně s pancytopenií, která často doprovází aplastickou anémii či se s ní překrývá, nebo myelodysplastickým syndromem. Jako subklinická forma se označuje onemocnění s přítomností PNH klonu bez vyjádřených klinických nebo laboratorních známek onemocnění.
Epidemiologie
Literárně udávaná incidence 1–1,5 na 1 milion obyvatel je pravděpodobně ve skutečnosti vyšší, výskyt u mužů a žen je rovnoměrný, v dětském věku se s PNH setkáváme velmi vzácně. Prevalence onemocnění je 1–1,3 na 100 tisíc obyvatel.
Etiopatogeneze
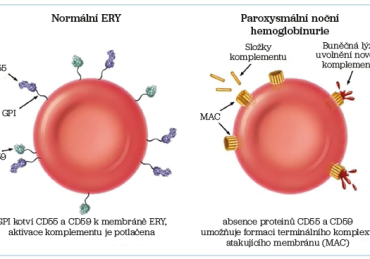
Onemocnění vzniká v důsledku získané mutace v PIG‑A genu, který kóduje tvorbu proteinu nutného pro syntézu GPI kotvy (glykosylfosfatidylinositol). GPI kotva umožňuje vazbu specifických proteinů s antigenní strukturou na povrchu buněk, včetně antigenu CD55 (inhibuje C3 a C5 složku komplementu) a antigenu CD59 (inhibitor terminálního komplexu komplementu). Deficit těchto proteinů vede k nekontrolované aktivaci komplementu a k hemolýze (obr. 1). Patologické klony erytrocytů (ERY) mají v důsledku ztráty ochranných mechanismů zkrácené přežívání. Podle přítomnosti GPI kotvených proteinů na povrchu se rozlišují erytrocyty: PNH I (reziduální, normální), PNH II (parciální deficit, syntéza částečně zachována), PNH III (kompletní deficit GPI proteinů). Zastoupení jednotlivých typů erytrocytů bývá variabilní. V rámci hemolýzy se uplatňuje jak hemolýza intravaskulární, která je spojena s deficitem CD59 vedoucím k lytickému působení terminálního komplementu (MAC – membrane attack complex), tak hemolýza extravaskulární spojená s deficitem CD55 vedoucím ke komplementem mediované destrukci erytrocytů v retikuloendotelovém systému jater a sleziny.
Anémie charakteristická pro PNH může být multifaktoriální etiologie. Vedle hemolýzy (typicky dominující u klasické formy) se může podílet dřeňová insuficience, deficit železa (Fe) či kyseliny listové jako důsledek ztrát.
V etiopatogenezi PNH hraje významnou úlohu hemoglobin (Hb) uvolněný z hemolyzovaných erytrocytů, který váže oxid dusnatý (NO) a dochází k vazokonstrikci. Pokles hodnot NO je spojen nejen s vazospasmy, ale též se spasmy hladkého svalstva, kteréžto se mohou projevovat jako specifické symptomy PNH.
Hyperkoagulační stav je při PNH komplexní povahy, uplatňuje se přímá aktivace koagulačního systému volným hemoglobinem, působení prokoagulačních mikropartikulí, deficit přirozených inhibitorů koagulace a fibrinolýzy či zvýšená hladina C5a složky komplementu.
Název onemocnění PNH je odvozen od pozorování nočních atak hemolýzy, které se projeví ráno hemoglobinurií. K mírné acidóze organismu dochází během spánku, kdy může dojít ke snadnější aktivaci komplementu při poklesu pH. Hemolýza není vázána pouze na noční období, většinou probíhá kontinuálně.
Klinické projevy
Anémie s různě vyjádřenými známkami anemického syndromu (slabost, dušnost, ikterus), ataky hemolýzy vedou k prohloubení tíže anémie, mohou být indukovány řadou mechanismů včetně infekčních stimulů (zvl. gastroenteritidy) či chirurgického zákroku. Hemoglobinurie zvláště při atace hemolýzy nebývá konstantní. Dystonie hladkého svalstva může mít pestré projevy zahrnující dysfagii, odynofagii, bolesti břicha, oprese na hrudi, erektilní dysfunkci. Trombotické komplikace se u PNH vyskytují frekventně, častěji postihují žilní než arteriální řečiště. Před nástupem léků cílených na inhibici komplementu byla TEN komplikace pozorována u 40 % pacientů. Vedle plicní embolie a hluboké končetinové žilní trombózy je nápadný výskyt žilních trombóz v atypických lokalitách – intraabdominální (portální, hepatální, mezenterická, splenická), cerebrální či dermální žíly. Buddův–Chiariho syndrom s obstrukcí hepatálních žil až dolní duté žíly není u PNH vzácností. PNH bývá asociována též s akutní či chronickou renální insuficiencí. Podkladem plicní hypertenze u PNH bývá plicní embolie nebo deplece NO v plicní cirkulaci.
Leukopenie a trombocytopenie lehkého stupně jsou velmi častým nálezem, klinicky závažné formy s významnou poruchou funkce kostní dřeně nacházíme u hypoplastické formy PNH.
Diagnostika onemocnění
Provedená vyšetření cílí na potvrzení hemolytické anémie, vyloučení jiných příčin hemolýzy (imunitní, mikroangiopatické, mechanické), posouzení orgánových funkcí. Stěžejní a diagnostické je vyšetření průtokovou cytometrií, které potvrdí přítomnost PNH klonu na buněčných liniích a kvantifikuje jeho velikost. Vyšetření kostní dřeně posoudí případný stupeň selhávání její funkce. Zobrazovací vyšetření jsou indikována cíleně při podezření na rozvoj komplikací PNH, zvláště trombotických.
Hematologická vyšetření
Krevní obraz + manuální diferenciální rozpočet + retikulocyty (tíže anémie, ev. leukopenie/trombocytopenie, retikulocytóza)
- v rámci vyloučení jiných příčin hemolýzy posouzení morfologie, přítomnosti schistocytů;
Flowcytometrie
- stanovení CD59‑ a CD 55‑negativních buněk v populaci ERY, Gran a Mono,
- posouzení stupně defektu ERY, stanovení velikosti PNH klonu (příp. vyšetření C3b na povrchu ERY),
- nutnost vyšetření i na jiné populaci než ERY (riziko podhodnocení PNH klonu při zkrácení živostnosti PNH‑ERY);
Kostní dřeň – u pacientů se signifikantní leukopenií a/nebo trombocytopenií. Posouzení ev. stupně dřeňové insuficience v nátěru krevních destiček a trepanobiopticky. Nález při cytogenetickém vyšetření může být přínosný pro diagnostiku PNH‑asociovaného myelodysplastického syndromu. Samotná PNH není spojena s chromozomálními změnami;
Koagulační vyšetření – v rámci diferenciální diagnostiky, elevace hodnot D‑dimerů při trombotické komplikaci;
Imunohematologie / přímý antiglobulinový test – k vyloučení imunitně podmíněné hemolýzy.
Biochemická vyšetření
Elektrolyty, renální a hepatální funkční testy vč. přímého a nepřímého bilirubinu, LDH.
Hodnota Fe, Ferritinu, k. listové, saturace transferinu – posouzení zásob a případného deficitu.
Stanovení volného hemoglobinu a haptoglobinu v séru.
Vyšetření moči na hemoglobin a hemosiderin.
Zobrazovací vyšetření
Ultrazvukové vyšetření (UZ) břicha, výpočetní tomografie (CT), magnetická rezonance (MRI) – cíleně při podezření na TEN komplikace, včetně atypických lokalizací (trombózy viscerálních či mozkových žil).
 Pro „klasickou“ hemolytickou formu PNH je typická hemolytická anémie s retikulocytózou, negativním výsledkem PAT (Přímý antiglobulinový test) a zvýšenou hodnotou LDH (typicky nad 1,5násobek normy). Hodnota hemoglobinu může být v pásmu hraniční anémie až těžké chudokrevnosti, která vyžaduje substituční léčbu. Diagnostické vyšetření průtokovou cytometrií potvrdí přítomnost klonální populace, její zastoupení může být velmi variabilní. U pacientů s klasickou formou se podíl PNH‑granulocytární populace pohybuje v rozmezí 40–99 %, zastoupení PNH‑erytrocytární populace je též variabilní, může být ovlivněno zkrácením přežívání defektních ERY a podáváním transfuzí. Pro diagnózu PNH není stanovena konkrétní hranice přítomnosti klonální populace nebo jejího typu. Počet leukocytů a trombocytů je normální nebo lehce snížený. Z dalších parametrů svědčí pro hemolýzu elevace hodnot bilirubinu (bývá zvýšena složka přímá i nepřímá), snížená hodnota haptoglobinu, zvýšení koncentrace volného plazmatického Hb potvrzuje intravaskulární rozpad krvinek. U pacientů s chronickou hemoglobinurií a hemosiderinurií se může rozvinout deficit Fe.
Pro „klasickou“ hemolytickou formu PNH je typická hemolytická anémie s retikulocytózou, negativním výsledkem PAT (Přímý antiglobulinový test) a zvýšenou hodnotou LDH (typicky nad 1,5násobek normy). Hodnota hemoglobinu může být v pásmu hraniční anémie až těžké chudokrevnosti, která vyžaduje substituční léčbu. Diagnostické vyšetření průtokovou cytometrií potvrdí přítomnost klonální populace, její zastoupení může být velmi variabilní. U pacientů s klasickou formou se podíl PNH‑granulocytární populace pohybuje v rozmezí 40–99 %, zastoupení PNH‑erytrocytární populace je též variabilní, může být ovlivněno zkrácením přežívání defektních ERY a podáváním transfuzí. Pro diagnózu PNH není stanovena konkrétní hranice přítomnosti klonální populace nebo jejího typu. Počet leukocytů a trombocytů je normální nebo lehce snížený. Z dalších parametrů svědčí pro hemolýzu elevace hodnot bilirubinu (bývá zvýšena složka přímá i nepřímá), snížená hodnota haptoglobinu, zvýšení koncentrace volného plazmatického Hb potvrzuje intravaskulární rozpad krvinek. U pacientů s chronickou hemoglobinurií a hemosiderinurií se může rozvinout deficit Fe.
U „hypoplastické formy“ PNH je vedle anémie přítomna výrazná trombocytopenie a leukopenie/neutropenie. Vyšetření kostní dřeně je zde obligátní.
Závěr
Včasná a správná diagnostika paroxysmální noční hemoglobinurie včetně rychlého odhalení případných komplikací je zásadní pro rozhodnutí o léčebném postupu. Současné léčebné možnosti umožňují velmi dobrou kontrolu onemocnění a zajištění vysoké kvality života nemocných.
MUDr. Antonín Hluší, Ph.D.
Hemato‑onkologická klinika FN Olomouc
E‑mail: antonin.hlusi@fnol.cz
Literatura
Brodsky RA. Paroxysmal nocturnal hemoglobinuria. Blood 2014;124:2804–2811.
Cançado RD, et al. Consensus statement for diagnosis and treatment of paroxysmal nocturnal haemoglobinuria. Hematol Transfus Cell Ther 2021;43:341–348.
Čermák J. Paroxysmální noční hemoglobinurie. Vnitr Lek 2018;64:508–513.
Hill A, et al. Thrombosis in paroxysmal nocturnal hemoglobinuria. Blood 2013;121:4985–4996.
Schrezenmeier H, et al. Baseline characteristics and disease burden in patients in the International Paroxysmal Nocturnal Hemoglobinuria Registry. Haematologica 2014;99. https://doi.org/10.3324/haematol.2013.093161