Parenterální suplementace železa pomocí karboxymaltózy železa
Železo je významný biogenní prvek. Článek shrnuje jeho metabolismus v lidském těle a poukazuje na dopady jeho nedostatku v organismu. Vyzdvihuje stavy, kdy je nezbytné parenterální podávání železa. Kromě sideropenických anémií se článek zaměřuje na vliv nedostatku železa u srdečního selhání. Zabývá se rovněž intravenózní suplementací železa u kardiální insuficience, která vede ke zlepšení stavu těchto nemocných.
Železo (chemická značka Fe, latinsky ferrum) je druhý nejrozšířenější kov na Zemi. Lidstvu je známo již od pravěku, ale k masivnímu, zvláště průmyslovému využití dochází až od 18. století. Dá se říci, že objev výroby železa byl jedním z milníků ve vývoji civilizace.
Nesmíme však zapomenout, že železo je zároveň velmi důležitý biogenní prvek, který nacházíme prakticky ve všech živých organismech. Vyskytuje se již od jednobuněčných organismů přes buňky rostlin až po savce. Ze všech biogenních prvků je železo v organismu obsaženo v největším množství. V lidském těle vážícím 70 kg je obsaženo asi 4 g železa. Největší množství železa v organismu je obsaženo v hemoglobinu (60–70 %), dále v myoglobinu a dalších enzymech (cytochromy, kataláza, peroxidáza aj.). Zhruba 30 procent je obsaženo ve vazbě na feritin, který představuje zásobní formu železa v organismu. V cirkulující krvi je přítomno méně než jedno procento železa.1,2 Kromě přenosu kyslíku ale železo v organismu plní řadu dalších důležitých funkcí. Je odpovědné za syntézu řady proteinů a replikaci nukleových kyselin. Má nepostradatelnou funkci v oblasti proliferace a dediferenciace buněk a apoptózy. Jeho nezastupitelná úloha je i v oblasti imunitního systému a v dalších systémech účastnících se homeostázy organismu.
Metabolismus železa
Železo, které přijímáme v potravě, je hlavně v oxidované podobě, tedy trojmocné Fe3+. To je obsaženo hlavně v obilovinách, luštěninách, zelenině a ovoci. Vlivem kyselého žaludečního prostředí je redukováno na dvojmocné Fe2+. Dvojmocné železo je obsaženo v červeném mase, drůbeži a mořských plodech. Vstřebávání železa probíhá převážně v duodenu a horním jejunu. Absorpce železa je výrazně ovlivněna současně přijímanou stravou. Látky jako fosfáty, fytáty, taniny a oxaláty vytvářejí se železem špatně vstřebatelné komplexy, které mohou snížit absorpci železa až o 10–15 procent. Podobně působí i mléko a mléčné výrobky.3 Vstřebávání samozřejmě ovlivňují i četné léky, jako například antacida, fluorochinolony či blokátory protonové pumpy.4 Vstřebávání železa je rovněž významně narušeno u onemocnění střev, jako jsou celiakie a Crohnova choroba, dále po resekčních výkonech na žaludku a tenkém střevu. Nemalou měrou se na omezené absorpci podílí rovněž achlorhydrie. Na druhou stranu existují látky, které absorpci železa zlepšují. Sem řadíme například kyselinu askorbovou a citronovou a také alfa a beta karoteny.3 Běžně se ze stravy vstřebá 0,5–2 mg železa, což za normálních okolností stačí k pokrytí potřeb organismu.1
Pro vstřebávání železa přes membránu enterocytu je důležitá bílkovina ferroportin. K cílovým tkáním v organismu je železo v trojmocné formě přenášeno pomocí transportního proteinu transferinu. Transferin se na povrchu buněk váže na transferinový receptor, celý komplex pak podléhá endocytóze s následným uvolněním železa v buňce.5 Na regulaci množství železa v organismu se podílí polypeptid hepcidin. Se stoupající koncentrací hepcidinu je sníženo uvolňování železa do extracelulárního prostoru. Stimulace syntézy hepcidinu je ovlivněna velkým množstvím působků, asi nejznámější je vliv některých cytokinů (interleukin 1 a interleukin 6), které mají za cíl snížit nabídku železa pro nádorové buňky a mikroorganismy. Ve výsledku však tento mechanismus vede ke vzniku anémie při chronickém onemocnění.6
Při ztrátách železa z organismu se uplatňuje regulační mechanismus, který se snaží zabránit rozvoji sideropenie. Spočívá v tom, že stoupá denní resorpce z potravy ze 7–10 procent na 20–25 procent přijaté dávky.5 Když však ztráty přesáhnou možnosti tohoto kompenzačního mechanismu, rozvíjí se sideropenie.
Sideropenie
Sideropenie je stav, při kterém je v organismu absolutní či relativní nedostatek železa. Rozlišujeme tři hlavní příčiny sideropenie. První příčinou jsou nadměrné ztráty železa z organismu, druhou je nedostatečný přísun železa a třetí jeho zvýšená spotřeba.
Nejčastější příčinou sideropenie jsou nadměrné ztráty železa z organismu. U žen velmi často způsobuje sideropenii krvácení z gynekologického traktu. Dle údajů Světové zdravotnické organizace je sideropenií postiženo 21 procent žen ve fertilním věku.3 Mezi další příčiny sideropenie patří krvácení ze zažívacího traktu. K nejzávažnějším příčinám se řadí peptické vředy, hiátová hernie, refluxní ezofagitida, benigní i maligní tumory a divertikly. I tak na první pohled banální onemocnění, jakým jsou hemeroidy, dovede vytvořit těžkou sideropenickou anémii. Na krvácení do zažívacího traktu se mnohdy podílejí i léky, jako kyselina acetylsalicylová, nesteroidní antirevmatika či antikoagulancia. Urologické afekce bývají méně častou, ale rozhodně ne zanedbatelnou příčinou sideropenie. Mezi vzácnější příčiny patří ztráty krvinek při hemodialýze či iatrogenně při častých a neuvážených krevních odběrech během hospitalizace.
Nedostatečný přísun železa v potravě v našich podmínkách můžeme pozorovat u striktních veganských diet, dále při poruchách resorpce z různých příčin. Naopak v rozvojových zemích je nedostatek železa v potravě velmi častý.
Zvýšená spotřeba železa se objevuje hlavně v těhotenství a při kojení.
Během rozvoje sideropenie mohou být patrna tři stadia. Stadium prelatentní sideropenie, kdy jsou vypleněny zásoby železa, ale dodávka pro tvorbu erytropoezy je stále ještě dostačující. Ve druhém stadiu, nazývaném latentní sideropenií, je snížena dodávka železa do erytroblastů, ale erytropoeza je stále zachována. Ve třetím stadiu, tzv. manifestní sideropenie, dochází již k rozvoji anémie.5
Anémie
Anémie znamená pokles hemoglobinu pod 135 g/l u mužů a pod 120 g/l u žen. Sideropenická anémie je nejčastějším hematologickým onemocněním a v celosvětovém měřítku nejčastější chorobou vůbec. Ve vyspělém světě se vyskytuje asi u pěti procent mužů a 8–20 procent žen. V rozvojových zemích je toto číslo značně vyšší a dosahuje výskytu až u 30–70 procent populace.7 Podle mezinárodních dat je sideropenickou anémií postiženo zhruba 1,2 miliardy lidí. A pouhá deficience železa bez anémie se dále vyskytuje u téměř dvojnásobku jedinců.8,9
Laboratorně manifestní sideropenická anémie je hypochromní (pokles střední koncentrace hemoglobinu v erytrocytech MCHC) a zároveň mikrocytární, kdy je snížen střední objem erytrocytů (MCV < 80 fl). Z dalších laboratorních metod stanovujeme koncentraci železa v séru, saturaci transferinu a koncentraci feritinu. Zároveň je zvýšená hodnota solubilních cirkulujících transferinových receptorů. Koncentrace feritinu však může být ovlivněna i řadou jiných faktorů, protože feritin patří mezi bílkoviny akutní fáze. Zvyšuje se proto při infekcích, zánětlivých a nádorových onemocněních.10
Při vyšetření pacientů se sideropenickou anémií vycházíme z anamnézy a fyzikálního vyšetření. Anémie může být zcela asymptomatická a prokážeme ji například zcela náhodou při preventivní prohlídce nebo pacienta k lékaři přivádějí potíže spojené s anemickým syndromem (slabost, nevýkonnost, dušnost, tachykardie) či příznaky onemocnění, které k anémii vedlo. Při pátrání po příčině krvácení do gastrointestinálního traktu můžeme využít vyšetření okultního krvácení. Tato metoda spočívá v imunochemickém stanovení hemoglobinu a detekuje krvácení do distálních partií střeva. Pro detekci kolorektálního karcinomu má senzitivitu 75 procent a specificitu 95 procent.10 Test okultního krvácení se používá i jako preventivní vyšetření. Při diagnostice sideropenické anémie mají jistě větší výpovědní hodnotu endoskopická vyšetření jako gastroskopie a kolonoskopie. Při negativním nálezu je nutné pátrat po ztrátách v oblasti tenkého střeva (např. CT enteroklýzou) a vyloučit malabsorpční onemocnění. U žen je samozřejmostí doplnit gynekologické vyšetření.
V léčbě sideropenické anémie musíme na prvním místě zjistit a odstranit její příčinu! Substituce železem bez průkazu zdroje krvácení by mohla být fatálním omylem. Při substituci železem volíme perorální formu. V dostupných přípravcích je železo přítomno v podobě dvojmocných nebo trojmocných solí. K tomu, aby se vstřebalo 50–60 mg železa (což vede k vzestupu hemoglobinu o 2 g/l denně) je třeba per os podat až 180–200 mg železa denně. Je vhodné toto množství rozdělit do dvou denních dávek. Přípravky by měly být podávány nalačno. Pacienta je nutno upozornit na možnost interference s jinými látkami v potravě, kterých by se měl vyvarovat.7,10 Perorální léčba železem bývá často zatížena nežádoucími efekty, často významnými, pro které je pacienti odmítají užívat. Mezi nejčastější nežádoucí účinky patří hlavně dyspeptické obtíže, bolesti břicha, nechutenství, zácpa a zvracení. Pacienta je rovněž nutno upozornit na přítomnost černé stolice. V případě vzniku nežádoucích příznaků je nutno vyzkoušet jiný přípravek železa, při jejich přetrvávání je nutno uvážit parenterální aplikaci železa.
Parenterální aplikace železa
Parenterální léčba u pacientů je indikována, když je příčinou snížená absorpce z gastrointestinálního traktu. Jedná se hlavně o pacienty s celiakií, Crohnovou chorobou, se syndromem krátkého střeva, po resekcích žaludku a bariatrických zákrocích, s píštělemi na střevu, dále při atrofické gastritidě. I významná intolerance perorální léčby železem nás opravňuje k intravenózní aplikaci. Další indikací pro parenterální podání železa, která se objevila v poslední době, je léčba chronického srdečního selhání.
Nitrožilně podané železo je dále zpracováváno makrofágy. V okamžiku, kdy se železo uvolní do cytoplazmy, může být uloženo do feritinu nebo exportováno do plazmy.11
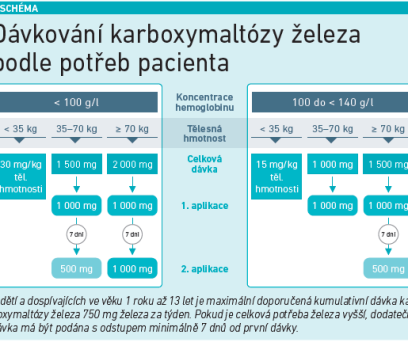 Při intravenózním podání se do organismu dostává přesně definované množství železa, proto musí být dávka individuálně stanovena. Například při podávání karboxymaltózy železa (FCM) vycházíme z koncentrace feritinu v séru < 100 µg/l nebo feritinu v séru 100–299 µg/l při saturaci transferinem (TSAT) pod 20 % a hodnoty hemoglobinu (viz schéma). Nesmíme ale překročit týdenní kumulativní dávku, která činí 1 000 mg železa. Zhodnocení léčby stanovením hemoglobinu a/nebo koncentrace feritinu by mělo proběhnout za čtyři týdny.
Při intravenózním podání se do organismu dostává přesně definované množství železa, proto musí být dávka individuálně stanovena. Například při podávání karboxymaltózy železa (FCM) vycházíme z koncentrace feritinu v séru < 100 µg/l nebo feritinu v séru 100–299 µg/l při saturaci transferinem (TSAT) pod 20 % a hodnoty hemoglobinu (viz schéma). Nesmíme ale překročit týdenní kumulativní dávku, která činí 1 000 mg železa. Zhodnocení léčby stanovením hemoglobinu a/nebo koncentrace feritinu by mělo proběhnout za čtyři týdny.
U intravenózního podání byly obavy z nežádoucích účinků. Mezi ně patřily bolest hlavy, vyrážka, nevolnost, zvracení, myalgie, artralgie a zvýšená teplota.12 Tyto reakce bývaly patrné u dřívějších přípravků. U současných přípravků, jako například FCM, jsou srovnatelné s placebem. A když srovnáme riziko závažných nežádoucích efektů při podání krevní transfuze (1 : 100 000) a riziko intravenózního podání železa (1 : 200 000), zjistíme, že je zhruba poloviční.13,14
Doposud jsem se v článku věnoval anémiím. Nyní bych se chtěl soustředit na další diagnózu, u které je důležitá suplemetace železem, a tou je chronické srdeční selhání.
Srdeční selhání a nedostatek železa
Deficience železa u srdečního selhání je poměrně častou záležitostí. Tento nález vede ke zhoršení kvality života nemocných a navozuje u nich vyšší riziko úmrtí a častější hospitalizace.
Nedostatek železa je spojen se sníženou bioenergetickou rezervou v orgánech vyžadujících vysoký přísun energie, jako je například srdeční sval.15 Dopady sideropenie na myokard jsou nejenom kvůli anémii, ale jedná se zde i o zásah do dýchacího řetězce, Krebsova cyklu a do metabolismu mitochondrií. U pacientů se srdečním selháním dochází k sideropenii dvěma mechanismy. Jedním je snížená resorpce železa, druhým omezená vnitřní recyklace železa.16 Pacienti často trpí nechutenstvím při kongesci zažívacího traktu, což je spojeno s poruchou resorpce železa. Dále se může projevovat i skryté krvácení, které může být potencováno protidestičkovou a antikoagulační terapií.17 Srdeční selhání je rovněž provázeno chronickým zánětem, při kterém dochází ke zvyšování koncentrace interleukinu 6. To způsobí ovlivnění koncentrace hepcidinu, což v důsledku vede k poruchám při využití zásobního železa a poruše resorpce železa ze střeva a v celkovém výsledku navodí inefektivní erytropoezu.18 U pacientů s akutně dekompenzovaným srdečním selháním je sideropenie přítomna ve více než dvou třetinách případů.19
Dle doporučení pro léčbu srdečního selhání z roku 2016 a 2021 byl deficit železa definován buď jako přítomnost koncentrace feritinu v séru < 100 ng/ml, nebo 100–299 ng/ml, pokud je saturace transferinu (TSAT) < 20 %.20,21 Již v doporučeních z roku 2016 bylo uvedeno, že u pacientů s výše uvedenými hodnotami metabolismu železa by mělo být zváženo podání karboxymaltózy železa ke zlepšení tolerance zátěže a kvality života. Tento poznatek vyšel ze závěru výsledků studií FAIR-HF a CONFIRM-HF.16,22,23 Guidelines z roku 2021 již navíc doporučují po deficitu železa cíleně pátrat. Rovněž do těchto doporučení byly zapracovány výsledky studie AFFIRM-AHF. Studie zahrnovala 1 132 pacientů, kteří byli nedávno hospitalizováni pro srdeční selhání a měli ejekční frakci levé komory < 50 %. U všech randomizovaných nemocných byl laboratorně prokázán deficit železa odpovídající výše uvedeným hodnotám doporučovaným v guidelines. Cílem studie bylo porovnání efektu intravenózně podané karboxymaltózy železa (FCM) oproti placebu. Aplikace FCM snížila riziko opakovaných hospitalizací o 26 procent.24 Podobné výsledky přinesla i studie IRONMAN, ve které však byla podávána jiná molekula – derizomaltóza železa. Její aplikace vedla ke snížení primárního cílového ukazatele – hospitalizací pro srdeční selhání a úmrtí z kardiovaskulárních příčin.25 Jistě se nyní naskýtá i otázka, zda by nebylo možno u pacientů se srdečním selháním podávat železo i perorálně. Tuto možnost vyvrátila studie IRONOUT-HF, publikovaná v roce 2017. Prokázala, že perorální aplikace železa u pacientů se srdeční insuficiencí není účinná.26
HEART-FID27,28 je největší a nejnovější publikovaná studie, která se se zabývala parenterální aplikací železa u pacientů se srdečním selháním. Tato studie randomizovala 3 065 pacientů. Hodnotila počet úmrtí, hospitalizací a změnu výkonnosti v šestiminutovém testu chůze. Pacienti byli randomizováni do dvou skupin. V jedné byla ke standardní léčbě srdečního selhání přidána FCM a ve druhé placebo. Do studie byli zařazeni pacienti, kteří byli hospitalizováni v posledních 12 měsících pro srdeční selhání nebo měli zvýšenou koncentraci NT-proBNP (> 600 pg/ml). Randomizovaní pacienti museli mít ejekční frakci levé komory ≤ 40 % a koncentraci hemoglobinu vyšší než 90 g/l a nižší než 135 g/l u žen a 150 g/l u mužů. Nedostatek železa byl definován jako pokles koncentrace feritinu < 100 µg/l nebo koncentrace 100–300 µg/l se současnou saturací transferinu < 20 %. Pacientům byla podávána vypočtená dávka podle tělesné hmotnosti, byly podány dvě dávky s odstupem sedmi dnů. FCM nebo placebo mohly být podány každých šest měsíců dle aktuálních hodnot hemoglobinu a železa. Již 160. den po zahájení studie vykazovala skupina léčená FCM výrazné zvýšení koncentrace sérového feritinu a po půlroční kontrole jeho koncentrace stoupla prakticky trojnásobně. Primární kompozitní cílový ukazatel byl hodnocen jako statisticky nevýznamný. Byl ale ovlivněn kvůli nestandardně nastavenému přísnému 99% intervalu spolehlivosti. Kdyby byl hodnocen při běžně užívaném 95% intervalu spolehlivosti, dosáhl by statistické významnosti pro léčbu FCM. Aplikace FCM se rovněž jevila jako bezpečná, protože závažné nežádoucí účinky byly podobné jako ve skupině placebové.
V roce 2023 byla prezentována rozsáhlá metaanalýza, kterou provedl Ponikowski se spolupracovníky. Zahrnovala výsledky ze studií, ve kterých byla pacientům podávána FCM (CONFIRM-HF, AFFIRM-HF, HEART-FID).28,29 Celkem bylo v těchto studiích zařazeno 4 501 nemocných. Metaanalýza prokázala významný benefit pro pacienty z podávání FCM ve smyslu snížení hospitalizací. Při analýze podskupin bylo dále zjištěno, že největší přínos z aktivní léčby FCM měli z hlediska kombinovaného cílového ukazatele KV hospitalizace a/nebo KV úmrtí pacienti s nejnižší saturací transferinu (TSAT < 15 %).
Závěr
Co říci závěrem? U pacientů, kteří potřebují parenterální substituci železem z různých příčin, se jeví podání karboxymaltózy železa jako nesmírně účinná a bezpečná léčba. Téma intravenózního podávání železa u pacientů se srdečním selháním a deficiencí železa, které v posledních několika letech rozvířilo odborné diskuse, ukázalo rovněž jednoznačný a nesmírný přínos podávání FCM u těchto pacientů. U nich parenterální substituce železa vede ke snížení počtu hospitalizací, ústupu symptomů, zlepšení tolerance námahy a v neposlední řadě ke zlepšení kvality života. Navíc minimum nežádoucích účinků při podávání tohoto přípravku může rozptýlit naše případné obavy, které by mohly limitovat jeho podání. Lze ho tak podávat v kardiologických a interních ambulancích nebo stacionářích. Pro pacienty není léčba rovněž nijak zatěžující, protože se nejedná o proceduru, na kterou by museli často docházet.
Domnívám se, že ve FCM máme k dispozici výborný a účinný lék jak pro léčbu pacientů s anémií, tak pro terapii nemocných se srdeční insuficiencí.
Literatura
- Novotný J. Sideropenická anémie. Med Pro Praxi. 2007;4(11):390–394.
- Slíva J. Železo a jeho využití v organismu. Remedia. 2013;23.
- Hronek M, Kovařík M. Deficit příjmu železa – nutriční zdroje, doporučené denní dávky, suplementace železem. Prakt Lékáren. 2021;17(4):213–215.
- Li W, Zeng S, Yu LS, et al. Pharmacokinetic drug interaction profile of omeprazole with adverse consequences and clinical risk management. Ther Clin Risk Manag. 2013;9:259–271.
- Čermák J. Léčba anémie a nedostatku železa z pohledu hematologa. Kardiol Rev Int Med. 2014;16(5):359–363.
- Čermák J. Nové poznatky v patogenezi a léčbě stavů se změněnými zásobami železa. Interní Med. 2012;14(12):461–464.
- Češka R, Štulc T, Tesař V, et al. Interna. Praha: Triton, 2015.
- Kassebaum NJ, Jasrasaria R, Naghavi M, et al. A systematic analysis of global anemia burden from 1990 to 2010. Blood. 2014;123(5):615–624.
- Camaschella C. Iron deficiency. Blood. 2019;133(1):30–39.
- Havlová E. Jak se neztratit v diferenciální diagnostice anémie. Medical Tribune. 2024;20(1):B6–B7.
- Richards T, Breymann C, Brookes MJ, et al. Questions and answers on iron deficiency treatment selection and the use of intravenous iron in routine clinical practice. Ann Med. 2021;53(1):274–285.
- Slipac J. Podávání intravenózního železa v bezkrevní medicíně. Čas Lék čes. 2009;148(10):497–501.
- Maniatis A. How we establish the correct use of blood and IV iron in the hospital setting? Perspectives in IV iron. International Series of Meetings. 2008;14–15.
- Muῆoz M, Acheson AG, Auerbach M, et al. International consensus statement on the peri-operative management of anaemia and iron deficiency. Anaesthesia. 2017;72(2):233–247.
- Melenovský V, Petrák J, Mráček T, et al. Myocardial iron content and mitochondrial function in human heart failure: a direct tissue analysis. Eur J Heart Fail. 2017;19(4):522–530.
- Bakošová M, Krejčí J, Špinarová L. Karboxymaltóza železa – slibná molekula v léčbě deficitu železa u pacientů se srdečním selháním. Cor Vasa. 2021;63(6):737–740.
- van der Wal HH, Grote Beverborg N, Dickstein K, et al. Iron deficiency in worsening heart failure is associated with reduced estimated protein intake, fluid retention, inflammation, and antiplatelet use. Eur Heart J. 2019;40(4):3616–3625.
- vaš. Železné horizonty v léčbě srdečního selhání. Medical Tribune. 2024;20(3):C2–C3.
- Melenovský V. Deficit železa u pacientů se srdečním selháním – studie AFFIRM-AHF. Acta medicinae. 2021;10(1–2):33–34.
- Ponikowski P, Voors AA, Anker SD, et al.; ESC Scientific Document Group. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129–2200.
- McDonagh TA, Metra M, Adamo M, et al.; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599–3726.
- Anker SD, Comin Colet J, Filippatos G, et al.; FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009;361(25):2436–2448.
- Ponikowski P, van Veldhuisen DJ, Comin Colet J, et al. CONFIRM-HF Trial: Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. 2015;36(11):657–668.
- Ponikowski P, Kirwan BA, Anker SD, et al. Ferric carboxymaltose for iron deficiency at discharge after acute heart failure: a multicentre, double-blind, randomised, controlled trial. Lancet. 2020;396(10266):1895–1904.
- Kalra PR, Cleland JGF, Petrie MC, et al. Intravenous ferric derisomaltose in patients with heart failure and iron deficiency in the UK (IRONMAN): an investigator-initiated, prospective, randomised, open-label, blinded-endpoint trial. Lancet. 2022;400(10369):2199–2209.
- Lewis GD, Malhotra R, Hernandez AF, et al. Effect of oral iron repletion on exercise capacity in patients with heart failure with reduced ejection fraction and iron deficiency: IRONOUT HF randomized clinical trial. JAMA. 2017;317(19):1958–1966.
- Mentz RJ, Garg J, Rockhold FW, et al. Ferric carboxymaltose in heart failure with iron deficiency. N Engl J Med. 2023;389(11):975–986.
- Bakošová M. Studie HEART-FID vnesla nové světlo do stanovování deficitu železa u pacientů se srdečním selháním. Acta Medicinae. 2024;13(2–3):83–84.
- Ponikowski P, Mentz RJ, Hernandez AF, et al. Efficacy of ferric carboxymaltose in heart failure with iron deficiency: an individual patient data meta-analysis. Eur Heart J. 2023;44(48):5077–5091.