Monoterapie iptakopanem u paroxysmální noční hemoglobinurie
Současným standardem péče u paroxysmální noční hemoglobinurie (PNH) je blokace komplementu na úrovni C5 složky pomocí ravulizumabu nebo ekulizumabu. Někteří pacienti s PNH však mohou rozvinout extravaskulární hemolýzu (EVH) během léčby inhibitory C5. Účinnost u pacientů s PNH prokázal nedávno inhibitor proximálního komplementu iptakopan. Článek autorů Füreder a kol. informuje o případu 43leté pacientky s PNH úspěšně léčené iptakopanem [1].
Úvod
Paroxysmální noční hemoglobinurie je vzácná získaná hematologická porucha charakterizovaná ztrátou glykosylfosfatidylinositol (GPI) vázaných proteinů na hematopoetických buňkách. Některé proteiny GPI se podílejí na regulaci komplementového systému a jejich nepřítomnost činí erytrocyty náchylnými k lýze zprostředkované komplementem. Kromě hemolytické anémie je PNH typicky spojena s trombofilií [2].
Inhibitor C5 složky komplementu ekulizumab způsobil revoluci v léčbě PNH [3]. V současné době je standardem péče o pacienty s PNH dlouhodobě působící ravulizumab [4]. Léčbou inhibitory C5 bývá intravaskulární hemolýza (IVH) u většiny pacientů dobře potlačena a riziko rozvoje trombózy je výrazně sníženo. Část pacientů však přesto zůstává anemická, což může být dáno EVH související s opsonizací erytrocytů C3 fragmenty a jejich následnou clearance ve slezině a játrech [5,6]. Problémem rovněž zůstává trvající riziko rozvoje akutních hemolytických krizí [5,6].
Inhibitory proximálního komplementu, které cílí na C3, faktor B nebo faktor D, zasahují do vyšších etáží komplementové kaskády a mohou díky tomu pomoci překonat jak IVH, tak EVH [7–9]. Na druhou stranu se díky tomu u těchto pacientů zvyšuje podíl GPI deficientních erytrocytů v periferním oběhu, a průlomová hemolýza (BTH) tak teoreticky může mít závažnější průběh [6]. Iptakopan je perorální přípravek, který inhibuje faktor B v alternativní dráze komplementu. V recentních klinických studiích prokázal u pacientů s PNH schopnost kontrolovat IVH a EVH, přičemž četnost a závažnost akutních hemolytických krizí byla relativně nízká.
Popis případu
U 43leté pacientky byla PNH diagnostikována v roce 2006. Léčba ravulizumabem u ní byla zahájena v roce 2017. Od listopadu 2019 do června 2021 se zúčastnila testování s látkou BXC9930. Po přerušení testovacího období dostala pacientka opět ravulizumab podávaný v dávce 3 300 mg každých osm týdnů. Kromě medikace cílené na PNH byla pacientka od roku 2006 léčena kabergolinem z důvodu rozvoje prolaktinomu. Nemocná zůstala navzdory terapii ravulizumabem anemická a rovněž se u ní vyvinula transfuzní závislost.
Anémie, vysoký počet retikulocytů, hodnota laktátdehydrogenázy (LDH) < 1,5× nad horní hranicí normálu (ULN, 250 U/l) a pozitivní Coombsův test na C3d svědčily o EVH. Léčba pegcetakoplanem nebyla v té době hrazena, nebylo ji tedy možné u pacientky použít. K dispozici byl iptakopan v rámci „Named Patient/Managed Access Programs“. Po informovaném souhlasu byla tedy u pacientky zahájena terapie iptakopanem v dávce 200 mg perorálně dvakrát denně počínaje dnem 41 po poslední dávce ravulizumabu. Nemocná podstoupila vakcinaci proti Neisseria meningitidis, Streptococcus pneumoniae a Haemophilus influenzae.
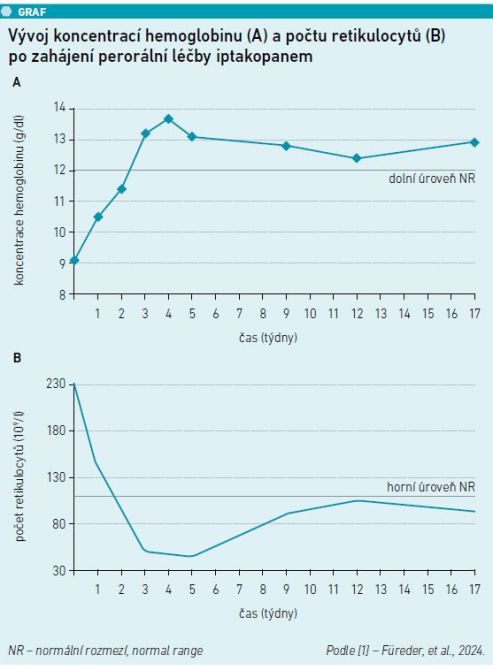 Po zahájení léčby iptakopanem se zvýšily hodnoty hemoglobinu z 9,1 g/dl na normální rozmezí (NR, 12,0–16,0 g/dl) ve třetím týdnu a zůstaly v rámci NR během celého sledování (graf 1A; tab. 1) [1]. Počet retikulocytů se snížil z 234,8 109/l na počátku terapie na NR v průběhu dvou týdnů (NR 32–110 109/l) (graf 1B; tab. 1) [1]. Hodnoty haptoglobinu zůstaly pod detekčním limitem. Skóre únavy FACIT (Functional Assessment of Chronic Illness Therapy) ukázalo výsledky srovnatelné se zdravými jedinci na začátku i během sledování (tab. 1) [1]. Velikost klonu erytrocytu byla ekvivalentní velikosti klonu granulocytu a zůstala stabilní z 96–100 % v průběhu sledování (tab. 1) [1].
Po zahájení léčby iptakopanem se zvýšily hodnoty hemoglobinu z 9,1 g/dl na normální rozmezí (NR, 12,0–16,0 g/dl) ve třetím týdnu a zůstaly v rámci NR během celého sledování (graf 1A; tab. 1) [1]. Počet retikulocytů se snížil z 234,8 109/l na počátku terapie na NR v průběhu dvou týdnů (NR 32–110 109/l) (graf 1B; tab. 1) [1]. Hodnoty haptoglobinu zůstaly pod detekčním limitem. Skóre únavy FACIT (Functional Assessment of Chronic Illness Therapy) ukázalo výsledky srovnatelné se zdravými jedinci na začátku i během sledování (tab. 1) [1]. Velikost klonu erytrocytu byla ekvivalentní velikosti klonu granulocytu a zůstala stabilní z 96–100 % v průběhu sledování (tab. 1) [1].
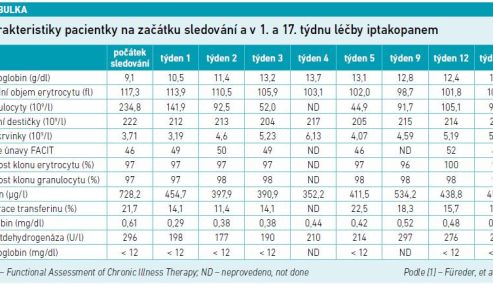 V důsledku transfuze červených krvinek se u pacientky rozvinulo mírné přetížení železem. Koncentrace feritinu činila 728,2 µg/ml před zahájením léčby iptakopanem, do prvního týdne terapie se podstatně snížila na 454,7 µg/l (tab. 1) [1]. Po vrcholu ve čtvrtém týdnu nepatrně poklesly hodnoty hemoglobinu a počty retikulocytů a LDH lehce vzrostly, což pravděpodobně naznačuje mírnou hemolýzu (graf 1; tab. 1) [1]. Nežádoucí účinky zahrnovaly zimnici bez horečky, mírné bolesti svalů a lehké zarudnutí, všechny příznaky během sledování ustoupily. Po 17 týdnech léčby iptakopanem koncentrace hemoglobinu zůstaly v rámci NR a skóre únavy FACIT bylo stabilní. Ačkoliv se počet retikulocytů z dosažených minimálních hodnot zvýšil, zůstal v rámci NR. Nevyskytly se žádné BTH ani infekce.
V důsledku transfuze červených krvinek se u pacientky rozvinulo mírné přetížení železem. Koncentrace feritinu činila 728,2 µg/ml před zahájením léčby iptakopanem, do prvního týdne terapie se podstatně snížila na 454,7 µg/l (tab. 1) [1]. Po vrcholu ve čtvrtém týdnu nepatrně poklesly hodnoty hemoglobinu a počty retikulocytů a LDH lehce vzrostly, což pravděpodobně naznačuje mírnou hemolýzu (graf 1; tab. 1) [1]. Nežádoucí účinky zahrnovaly zimnici bez horečky, mírné bolesti svalů a lehké zarudnutí, všechny příznaky během sledování ustoupily. Po 17 týdnech léčby iptakopanem koncentrace hemoglobinu zůstaly v rámci NR a skóre únavy FACIT bylo stabilní. Ačkoliv se počet retikulocytů z dosažených minimálních hodnot zvýšil, zůstal v rámci NR. Nevyskytly se žádné BTH ani infekce.
Diskuse
U některých pacientů s PNH léčených inhibitory C5 zůstává problémem přetrvávající anémie [7–9]. Pegcetakoplan je inhibitor C3, který se podává v subkutánní infuzi dvakrát až třikrát týdně [7]. Iptakopan, který cílí na faktor B, se podává perorálně dvakrát denně [9]. Oba léky se používají jako monoterapie, zatímco danikopan (podávaný perorálně třikrát denně) cílící na faktor D je používán jako doplňková léčba k inhibici C5 pomocí ekulizumabu nebo ravulizumabu [8]. Přímé srovnání těchto inhibitorů proximálního komplementu chybí a je třeba zpracovat algoritmy pro určení toho, který lék nejlépe vyhovuje požadavkům konkrétních pacientů.
Uvedená kazuistika informuje o pacientce s PNH a EVH úspěšně léčené iptakopanem v monoterapii [1]. V klinické studii, která hodnotila přechod pacientů z léčby inhibitory C5 na monoterapii iptakopanem, vykazoval iptakopan superioritu oproti inhibitorům C5 ve zvýšení koncentrací hemoglobinu, zmírnění únavy a snížení počtu retikulocytů, s následnou normalizací hodnot LDH < 1,5 × ULN [9].
Těžká BTH je u pacientů s PNH léčených iptakopanem pozorována jen zřídka [9]. U sledované pacientky byla mírná hemolýza rozpoznána v devátém týdnu po zahájení léčby iptakopanem, avšak neodpovídala kritériím BTH (s nárůstem hodnot LDH > 2 × ULN) [4]. Jedním z vysvětlení může být to, že se komplement „naučil“, jak uniknout blokádě faktoru B. Další možností může být problém s compliance, což se však jeví nepravděpodobné, neboť u pacientky byl zaznamenán významný přínos terapie iptakopanem.
V klinických studiích s iptakopanem průměrné koncentrace hemoglobinu od výchozího stavu do 24. týdne vykazovaly mírný pokles ve 12. týdnu [9]; nicméně interpretace individuálních reakcí pacientů jsou omezené.
Je zajímavé, že sledovaná nemocná měla před zahájením terapie iptakopanem zvýšené hodnoty feritinu, které poklesly krátce po začátku léčby [1]. Vysvětlením pro toto zjištění může být zvýšená inkorporace železa do většího počtu červených krvinek. Jakmile se stabilizovaly hodnoty hemoglobinu, normalizovaly se rovněž koncentrace feritinu, třebaže na nižší úrovni. Toto bylo nedávno pozorováno také u pacienta léčeného danikopanem (v rámci nepublikovaného výzkumu).
Hodnoty haptoglobinu zůstaly pod detekčním limitem i přes dobrou klinickou odpověď na iptakopan. Toto pozorování lze vysvětlit velmi mírnou hemolýzou bez anémie.
Nežádoucí účinky u pacientky zahrnovaly zimnici, návaly horka a lehké bolesti svalů. Zda tyto nežádoucí příhody byly skutečně spojeny s léčbou iptakopanem, není možné potvrdit. Všechny uvedené reakce nebyly závažné, vyřešily se během sledování a nevedly k přerušení léčby [1].
Shrneme‑li, má monoterapie iptakopanem potenciál k normalizaci hodnot hemoglobinu a počtu retikulocytů u pacientů s PNH a EVH. U sledované pacientky byl iptakopan navíc dobře snášen bez BTH nebo jiných relevantních nežádoucích účinků.
Literatura
- Füreder W, Thalhammer R, Valent P. Resolution of extravascular hemolysis with oral iptacopan monotherapy in a patient with treatment experienced paroxysmal nocturnal hemoglobinuria (PNH). Wien Klin Wochenschr 2024; 136: 472–475.
- Hillmen P, Lewis SM, Bessler M, et al. Natural history of paroxysmal nocturnal hemoglobinuria. N Engl J Med 1995; 333: 1253–1258.
- Hillmen P, Young NS, Schubert J, et al. The complement inhibitor eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2006; 355: 1233–1243.
- Kulasekararaj AG, Griffin M, Langemeijer S, et al. Long‑term safety and efficacy of ravulizumab in patients with paroxysmal nocturnal hemoglobinuria: 2‑year results from two pivotal phase 3 studies. Eur J Haematol 2022; 109: 205–214.
- Risitano AM, Notaro R, Marando L, et al. Complement fraction 3 binding on erythrocytes as additional mechanism of disease in paroxysmal nocturnal hemoglobin uria patients treated by eculizumab. Blood 2009; 113: 4094–4100.
- Notaro R, Luzzatto L. Breakthrough Hemolysis in PNH with Proximal or Terminal Complement Inhibition. N Engl J Med 2022; 387: 160–166.
- Hillmen P, Szer J, Weitz I, et al. Pegcetacoplan versus Eculizumab in Paroxysmal Nocturnal Hemoglobinuria. N Engl J Med 2021; 384: 1028–1037.
- Lee JW, Griffin M, Kim JS, et al. Addition of danicopan to ravulizumab or eculizumab in patients with paroxysmal nocturnal haemoglobinuria and clinically significant extravascular haemolysis (ALPHA): a double‑blind, randomised, phase 3 trial. Lancet Haematol 2023; 10: e955–e965.
- Peffault de Latour R, Röth A, Kulasekararaj AG, et al. Oral Iptacopan Monotherapy in Paroxysmal Nocturnal Hemoglobinuria. N Engl J Med 2024; 390: 994–1008.