Léčba paroxysmální noční hemoglobinurie

Paroxysmální noční hemoglobinurii (PNH) řadíme mezi velmi vzácná onemocnění krvetvorby. Příčinou onemocnění je získaný genetický defekt (mutace genu) PIG‑A (phosphatidylinositol glycan anchor biosynthesis class A), který je lokalizován na chromozomu X. Chybění tohoto genu vede k deficienci struktur, které jsou kotveny na membráně krvinky a za normálních okolností chrání krvinky před jejich zánikem působením komplementu. Mezi tyto chybějící struktury řadíme regulátor proximální dráhy komplementu CD55 a regulátor terminální složky komplementu CD59. Chybění těchto složek na membráně erytrocytů, a i dalších krvinek je základem flowcytometrické diagnostiky pacientů s paroxysmální noční hemoglobinurií.
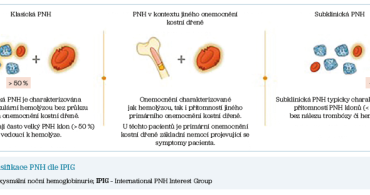 Onemocnění se obvykle manifestuje anémií s klasickými klinickými příznaky, jako jsou dušnost nebo nevýkonnost. Výraznou únavou je postiženo přibližně 75-89 % pacientů s PNH. Příčinou anémie je intravaskulární rozpad červených krvinek (hemolýza) zapříčiněný aktivovaným komplementem. Další příčinou vzniku anémie může být primární selhání kostní dřeně, sem řadíme například pacienty s aplastickou anémií s přítomností PNH klonu. Klinické rozdělení onemocnění můžeme definovat podle kritérií IPIG (International PNH Interest Group) (obr. 1).
Onemocnění se obvykle manifestuje anémií s klasickými klinickými příznaky, jako jsou dušnost nebo nevýkonnost. Výraznou únavou je postiženo přibližně 75-89 % pacientů s PNH. Příčinou anémie je intravaskulární rozpad červených krvinek (hemolýza) zapříčiněný aktivovaným komplementem. Další příčinou vzniku anémie může být primární selhání kostní dřeně, sem řadíme například pacienty s aplastickou anémií s přítomností PNH klonu. Klinické rozdělení onemocnění můžeme definovat podle kritérií IPIG (International PNH Interest Group) (obr. 1).
Dalším závažným klinickým projevem onemocnění jsou trombotické komplikace v arteriálním či venózním řečišti, nezřídka v oblasti jaterních či slezinných žil, v mozkových splavech, tj. v klinicky atypických lokalizacích trombózy. Zhruba 29-44 % pacientů s PNH prodělá během svého života více než jednu trombózu. Příčinou trombotických komplikací je aktivace systému intravaskulární hemolýzy (IVH) s následným velmi vysokým trombotickým potenciálem. Riziko trombózy je u těchto nemocných výrazně zvýšeno a není zcela odstraněno ani účinnou antikoagulační léčbou, pokud není stabilizováno základní onemocnění. Další klinické potíže u pacientů s PNH mohou zahrnovat polykací obtíže v oblasti jícnu při poruše motility a křečích jícnu, dále dušnost při chronické plicní hypertenzi a u mužů i erektilní dysfunkci. Pacienti s chronickou hemolýzou často trpí i chronickým selháním ledvin.
Možnosti léčby
Historická podpůrná léčba onemocnění spočívá v dodávání chybějících červených krvinek transfuzemi, pokud má pacient příznaky anemického syndromu, a v primární či sekundární prevenci trombotických komplikací podáváním látek zmírňujících srážení krve. Pacienti s aplastickou anémií a s PNH klonem, u nichž převažuje postižení kmenové buňky, jsou léčeni v rámci specializovaných hematologických center podáním velmi silné imunosuprese či jsou směrováni k provedení transplantace krvetvorných buněk.
V posledním desetiletí se v oblasti terapie PNH objevily monoklonální protilátky, které zcela změnily léčbu onemocnění. Léčba inhibitory komplementu podstatně snížila trombotické riziko nemoci a výrazně zmírnila klinické potíže pacientů.
Historicky prvním přípravkem schváleným pro léčbu pacientů s PNH byl ekulizumab. Ekulizumab je monoklonální protilátka, jejíž účinek je cílen na zastavení rozpadu krvinek cestou blokády C5 složky komplementu. Léčba pacientů spočívá v pravidelném 14denním parenterálním podávání 900 mg ekulizumabu. Před podáním léčby všemi inhibitory komplementu je povinnost všechny pacienty očkovat proti meningokokové infekci.
Před několika lety se do klinické praxe dostala i druhá generace inhibitoru komplementu, a to ravulizumab. Ravulizumab je upravený inhibitor komplementu, jenž poskytuje rychlou, kompletní a setrvalou inhibici C5 složky komplementu. Tato upravená molekula umožňuje parenterální podání s intervalem osm týdnů a je vhodná pro stabilní pacienty bez výrazné průlomové nebo extravaskulární hemolýzy (EVH). V rámci jednotlivých států byla publikována doporučení stran léčby pacientů s PNH, zde uvádíme pro ilustraci britská doporučení pro léčbu pacientů s PNH.
Cílem efektivní léčby PNH je kontrola IVH a vymizení klinických potíží pacienta. Nyní dostupné inhibitory C5 složky komplementu – ekulizumab a ravulizumab – prodloužily přežití pacientů s PNH a zmírnily projevy onemocnění kontrolou IVH, což se odráží ve snížení koncentrace sérové laktátdehydrogenázy (LDH).
Praktické zkušenosti s léčbou inhibitory komplementu můžeme dokumentovat krátkými kazuistikami.
Praktické zkušenosti v kazuistikách
Naším prvním pacientem je 63letý muž, jenž byl dlouhodobě sledován na hematologii pro trombocytopenii a makrocytární anémii. V rámci diferenciální diagnostiky makrocytární anémie byl zjištěn PNH klon II. a III. typu. Pacient byl léčen cyklosporinem a kortikoidy s minimálním efektem. V dalším průběhu dochází k progresi hemolýzy se vzestupem hodnoty LDH nad 20 µkat/l a s následnou transfuzní dependencí. Klinicky se onemocnění manifestuje jako klasický typ PNH s atakami erytrocyturie. V roce 2020 pacient prodělal středně závažnou infekci covid‑19 bez trombotických komplikací, ale došlo k výraznému zhoršení transfuzní dependence. Vzhledem k těmto skutečnostem byl pacient indikován k léčbě blokátorem komplementu ravulizumabem (Ultomiris). Po povinné vakcinaci proti meningokoku jsme zahájili léčbu ravulizumabem v první linii v úvodním dávkování s následným převodem na frekvenci aplikací 1× za 8 týdnů. Pacient léčbu velmi dobře toleruje, došlo k normalizaci paramentů hemolýzy, transfuzně je independentní.
Naší druhou pacientkou je 65letá žena, u níž byla v roce 2015 diagnostikována klasická hemolytická forma paroxysmální hemoglobinurie. Pacientka byla léčena na spádové hematologii podáváním kortikoidů a transfuzí při anemickém syndromu. I u ní prodělání infekce covid‑19 znamenalo výrazné zhoršení anémie s nutností intenzivního podávání krevních transfuzí. V roce 2021 jsme zahájili léčbu podáváním přípravku Ultomiris v první linii. Laboratorně došlo k velmi rychlé stabilizaci paramentů hemolýzy a k transfuzní independenci. Pacientka dosáhla normalizace hodnot hemoglobinu bez jasných známek extravaskulární hemolýzy. Vzhledem k aktivnímu pracovnímu zařazení pacientka velmi oceňuje osmitýdenní dávkovací interval, jenž má za následek minimální počet zmeškaných pracovních dní.
Publikované kazuistiky dokazují velmi dobrý efekt inhibitorů komplementu podávaných v první linii u pacientů s paroxysmální noční hemoglobinurií.
I přes velmi účinnou léčbu inhibitory C5 složky komplementu asi 82 % pacientů nedosahuje normalizace hodnoty hemoglobinu. Z těchto pacientů má 10-29 % reziduální intravaskulární hemolýzu (IVH), která je způsobena suboptimální inhibicí C5 složky komplementu, a 25-50 % má extravaskulární hemolýzu (EVH). Příčinou tohoto stavu může být zvýšení aktivity EVH na podkladě akumulace C3b složky komplementu a následně C3 mediované opsonizace erytrocytů, jež ústí v extravaskulární fagocytózu. V léčbě těchto pacientů se nyní uplatňují blokátory alternativní dráhy komplementu. Jako první inhibitor alternativní dráhy komplementu získal schválení ke klinickému užití přípravek pegcetakoplan. Pegcetakoplan (Aspaveli, Sobi) je symetrická cyklická molekula tvořená dvěma identickými pentadekapeptidy, které jsou kovalentně vázány na polyethylenglykol. Pegcetakoplan se s vysokou afinitou váže na C3 složku komplementu (a její aktivační fragment C3b), čímž inhibuje štěpení C3 na C3a a C3b a aktivaci dalších částí komplementové kaskády. Tím reguluje jak intravaskulární hemolýzu (zprostředkovanou membránu atakujícím komplexem), tak i extravaskulární hemolýzu (zprostředkovanou C3).
S pegcetakoplanem byly publikovány dvě multicentrické randomizované otevřené studie III. fáze PEGASUS a PRINCE. Na základě výsledků publikovaných studií byl pegcetakoplan registrován ke klinickému použití. V České republice je pegcetakoplan (Aspaveli) v současné době indikován k léčbě dospělých pacientů s paroxysmální noční hemoglobinurií, kteří mají anémii i po minimálně tříměsíční léčbě inhibitorem C5. Inhibitory alternativní dráhy komplementu nyní představují perspektivní směr léčby pacientů s paroxysmální noční hemoglobinurií. Fázi klinického testování je podrobována kombinace inhibitoru faktoru D s ekulizumabem nebo ravulizumabem. Další přípravek, a to iptakopan, perorální inhibitor faktoru B, již úspěšně prošel klinickými studiemi u pacientů s PNH a byl pro jejich registrován americkým Úřadem pro kontrolu potravin a léčiv (FDA) i Evropskou lékovou agenturou (EMA).
Závěr
Léčba paroxysmální noční hemoglobinurie, tohoto velmi vzácného onemocnění, prodělala za posledních několik let výrazný pokrok. Prvotní substitučně symptomatický postup byl u rizikových nemocných nahrazen cílenou léčbou monoklonálními protilátkami blokujícími C5 složku komplementu. I přes výrazný efekt stran stabilizace intravaskulární hemolýzy a zlepšení hladiny hemoglobinu ne všichni pacienti dosáhli transfuzní nezávislosti a normalizace laboratorních parametrů. Při léčbě inhibitory C5 navíc část pacientů vykazuje i zvýšenou aktivitu extravaskulární hemolýzy. V rámci dalšího výzkumu pokrok vedl k účinné blokádě alternativní dráhy komplementu. Jako první se v této skupině léků etabloval pegcetakoplan, jenž působí inhibicí štěpení C3 složky komplementu. Jako další perspektivní možnost inhibice alternativní dráhy komplementu se jeví podávání inhibitoru faktoru B iptakopanu.
MUDr. Libor Červinek, Ph.D.
Interní hematologická a onkologická klinika MU a FN Brno
E‑mail: cervinek.libor@fnbrno