Kdo má u karcinomu pankreatu a cholangiokarcinomu naději na delší přežití?
Karcinom pankreatu a cholangiokarcinom představují onemocnění, u nichž se v čase prognóza nemocných lepší jen velmi málo. Křivky incidence a mortality se u těchto dvou nádorů skoro překrývají, to znamená, že téměř každý pacient v důsledku zhoubného novotvaru i zemře. O to více je zde zapotřebí soustředěného úsilí všech zainteresovaných. Na to, co je možné pro tyto nemocné udělat dnes a co by se pro ně dalo udělat v blízké budoucnosti, se zaměřilo sympozium podpořené společností Servier, které proběhlo v rámci programu letošního kongresu PragueONCO.
Sympozium otevřel prof. MUDr. Luboš Petruželka, CSc., z Onkologické kliniky 1. LF UK, VFN a ÚVN: „Jak u karcinomu pankreatu, tak u cholangiokarcinomu jsou výsledky léčby neuspokojivé. Záměrem naší diskuse je přispět k optimalizaci léčby těchto nádorů na základě dat a zkušeností. V obou případech je cestou vpřed znalost biologie nádoru, s tím souvisí i potřeba časného genomického testování.“
Cílem léčby metastatického karcinomu pankreatu je vystavět léčebnou sekvenci tak, aby nemocný maximálně profitoval z co nejvíce léčebných linií při zachování dobré kvality života. O tom, co je třeba vzít v úvahu při tvorbě léčebné strategie, hovořil MUDr. Stanislav Batko z Onkologické kliniky 2. LF UK a FN Motol. Připomněl, že pro první linii je podle doporučení Evropské společnosti pro klinickou onkologii (ESMO) možné použít dublet chemoterapie gemcitabin + nab‑paklitaxel (Gem/Nab‑P) nebo modifikovaný režim FOLFIRINOX (mFOLFIRINOX) a u pacientů, kteří jsou křehcí a v horším celkovém stavu, monoterapii gemcitabinem [1]. S tímto nastavením jsou v souladu i americké guidelines a také česká „Modrá kniha“, tedy doporučené postupy České onkologické společnosti ČLS JEP.
Léčba první linie by neměla zavírat dveře k liniím dalším
„Dlouho v praxi převládal přístup, kdy u mladších nemocných byl preferován režim FOLFIRINOX a dublet Gem/Nab‑P byl považován za vhodnější pro pacienty, kteří by nezvládli agresivnější léčbu. Přímé porovnání těchto dvou možností ale dlouho chybělo. Nyní jsou již k dispozici data, která ukazují, že pokud jde o účinnost, jsou oba režimy srovnatelné, a to napříč různými populacemi nemocných,“ řekl MUDr. Batko a v této souvislosti zmínil např. recentně publikovanou japonskou studii GENERATE [2]. Ta přímo porovnávala Gem/Nab‑P a mFOLFIRINOX u nepředléčených pacientů s metastatickým adenokarcinomem pankreatu. „Z průběhu křivek vidíme, že přežití se nijak zásadně neliší, u Gem/Nab‑P dosáhlo 17 měsíců a u mFOLFIRINOX to bylo 14 měsíců. Numericky je tedy dokonce favorizováno přežití s režimem Gem/Nab‑P, tento rozdíl ale nedosáhl hranice statistické významnosti. V každém případě data z této studie neukazují na žádnou skupinu, kde by použití mFOLFIRINOX bylo superiorní, což platí i pro BRCA pozitivní nádory,“ popsal MUDr. Batko.
K podobnému závěru došla rovněž studie PASS‑01, jejíž první výsledky byly zveřejněny loni [3]. Šlo o multicentrickou, randomizovanou studii fáze II, která proběhla v USA. Zde bylo 150 nepředléčených pacientů v dobrém výkonnostním stavu rozděleno do dvou skupin, první byla léčena režimem mFOLFIRINOX, druhá režimem Gem/Nab‑P. Ani zde nebyl režim Gem/Nab‑P inferiorní. Přežití bez progrese onemocnění bylo totožné – 5,7 měsíce, u pětiny pacientů s basal‑like karcinomem byl rozdíl v PFS 5,7 versus 2,7 měsíce ve prospěch režimu Gem/Nab‑P. Podobně dopadlo hodnocení celkového přežití – 9,7 versus 8,4 měsíce ve prospěch léčby Gem/Nab‑P. „I u této studie vidíme téměř se překrývající křivky přežití, a máme tak v ní další podporu pro to, že s režimem s nab‑paklitaxelem nikomu neubíráme šanci na prodloužení života,“ komentoval MUDr. Batko. Cílem této práce bylo mimo jiné přispět k hledání biomarkerů pro řízení léčby metastatického karcinomu pankreatu. Součástí protokolu proto bylo vyšetření sekvenováním nové generace. To úspěšně proběhlo u 80 procent zařazených nemocných, v tomto ohledu ještě probíhají podrobnější analýzy.
Na danou otázku již odpovídá také metaanalýza publikovaná v roce 2024 [4]. Zahrnuje sedm studií s více než 2 500 pacienty a i ona ukazuje na srovnatelné přežití u obou léčebných modalit. „A ani zde nenalézáme žádné vodítko, proč by některá skupina měla z FOLFIRINOX profitovat,“ komentoval MUDr. Batko.
Tím, čím se oba režimy liší, je profil nežádoucích účinků – a to by podle MUDr. Batka mohlo být vodítkem pro rozhodování mezi nimi.
 U karcinomu pankreatu více než u jiných onemocnění platí, že léčba první linie je určující pro terapeutické možnosti v linii druhé. Hlavní rozdíl mezi zmíněnými režimy je v tom, co se děje po progresi onemocnění. Pokud je nemocný iniciálně předléčen režimem s gemcitabinem, v druhé linii pak může dostat režim s pegylovaným lipozomálním irinotekanem (přípravek Onivyde) v kombinaci s 5‑fluorouracilem a leukovorinem (5‑FU/LV).
U karcinomu pankreatu více než u jiných onemocnění platí, že léčba první linie je určující pro terapeutické možnosti v linii druhé. Hlavní rozdíl mezi zmíněnými režimy je v tom, co se děje po progresi onemocnění. Pokud je nemocný iniciálně předléčen režimem s gemcitabinem, v druhé linii pak může dostat režim s pegylovaným lipozomálním irinotekanem (přípravek Onivyde) v kombinaci s 5‑fluorouracilem a leukovorinem (5‑FU/LV).
„Na progresi při léčbě první linie je třeba včas reagovat. Máme jen jednu studii fáze III, která prokázala signifikantní prodloužení přežití v druhé linii, a tou je NAPOLI‑1 s pegylovaným lipozomálním irinotekanem v kombinaci s 5‑FU/LV. To ovlivnilo také formulaci platných guidelines pro tuto klinickou situaci, v doporučených postupech ESMO je tato modalita označena jako preferovaná. Už z dat studie NAPOLI‑1 víme, že je zde skupina pacientů, kteří mohou mít z této léčby dlouhodobý profit [5].“
Na otázku, čím se odlišují pacienti, kteří relativně dlouhodobě přežívají při tak agresivním onemocnění, hledala odpověď studie NALLONG [6]. Tato retrospektivní neintervenční studie byla provedena v Rakousku, Belgii, Německu, Japonsku a Jižní Koreji. Byli do ní zařazeni nemocní léčení v reálné klinické praxi režimem nal‑IRI/5FU/LV poté, co absolvovali léčbu založenou na gemcitabinu a přežili déle než jeden rok. Z výsledků prezentovaných na kongresu ESMO v roce 2024 vyplývá, že medián přežití od zahájení léčby režimem s nal‑IRI byl 21 měsíců. Medián celkového přežití od okamžiku diagnózy metastatického karcinomu pankreatu dosáhl v tomto souboru 34,3 měsíce. Takto dlouhé celkové přežití u selektované skupiny nemocných by podle autorů práce mělo být předmětem dalšího vědeckého zájmu.
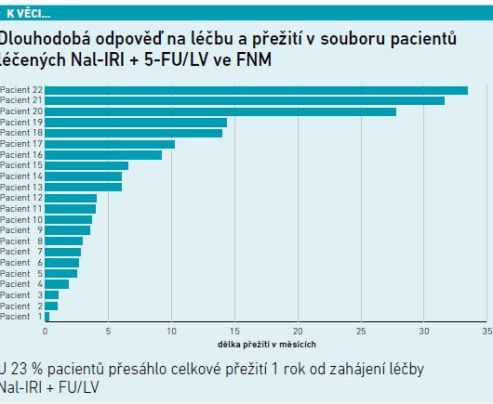
V tomto kontextu MUDr. Batko zmínil vlastní klinická data z jeho pracoviště, vycházející z neselektovaného souboru 22 pacientů léčených pegylovaným lipozomálním irinotekanem. Mezi nimi je pět, jejichž přežití na léčbě tímto přípravkem přesahuje jeden rok, u tří z nich přežití překonalo hranici dvou let (viz graf). „I v naší praxi vidíme skupinu, u které pegylovaný lipozomální irinotekan funguje v nádorovém mikroprostředí mnohem lépe než běžný irinotekan. Nemáme zatím prediktivní nástroj, jak tyto nemocné identifikovat. Měli jsme i pacienta, který atakoval hranici pěti let přežití od diagnózy, z toho 33 měsíců na této terapii– a zrovna on původně vstupoval do léčby jako velmi křehký, kdy z důvodu celkového stavu dostával jen gemcitabin v monoterapii,“ popsal MUDr. Batko.
Příležitost pro personalizovanou medicínu se otevírá, zatím z toho profitují jen jednotlivci
Na nejnovější možnosti léčby karcinomu pankreatu se zaměřil MUDr. Stanislav John, Ph.D., z Kliniky onkologie a radioterapie LF UK a FN Hradec Králové. Také on ukázal, že i u metastatického karcinomu pankreatu lze dosáhnout významného prodloužení přežití. Ve studii NAPOLI‑1 plných 25 procent nemocných léčených pegylovaným lipozomálním irinotekanem žilo déle než rok, zatímco v kontrolní větvi to bylo pouze 13 procent. Své sdělení MUDr. John zahájil kazuistikou pacienta, u něhož byla v srpnu 2020 stanovena diagnóza karcinomu těla pankreatu (cT4 cN1 M1) s metastázami potvrzenými v játrech a na peritoneu. Byl léčen chemoterapií i radioterapií. V důsledku progrese onemocnění došlo ke stenóze rekta, která si v květnu 2023 vyžádala zavedení terminální sigmoideostomie. Pacient byl převeden na režim pegylovaný lipozomální irinotekan plus 5‑FU/LV. Po nasazení této léčby v říjnu 2023 byla dokumentována parciální regrese primárního tumoru i ústup metastáz, biomarker CA‑19‑9 byl negativní. „Pozorovali jsme také ústup klinických obtíží a pacient přibral na váze. Do ledna 2025 bylo zatím podáno 25 cyklů s dobrou tolerancí,“ uvedl MUDr. John.
Nemocný podstoupil i vyšetření sekvenováním nové generace (NGS) s výsledkem přítomnosti mutace KRAS G12R a suspektní ATM germinální patogenní mutace, tu následně potvrdilo i genetické vyšetření. „Tyto informace mohou být užitečné, až budeme uvažovat, co dále po progresi onemocnění,“ řekl MUDr. John.
MUDr. John připomněl, že u metastatického karcinomu pankreatu je z hlediska klinického hodnocení nových léků úspěch vzácný. Za posledních deset let selhalo 21 studií – výjimku tvoří studie NAPOLI‑1 a NAPOLI‑3, a pak také studie s olaparibem v udržovací léčbě u podskupiny s BRCA pozitivním nádorem.
Právě studie NAPOLI‑3 by mohla změnit klinickou praxi v dohledném horizontu [7]. Hodnotila režim NALIRIFOX (pegylovaný lipozomální irinotekan, 5‑fluorouracil, leukovorin a oxaliplatina) v první linii u 770 pacientů s metastatickým, dosud neléčeným karcinomem pankreatu. (Dávkování je v tomto případě jiné než ve druhé linii a odlišné (nižší) od běžného dávkování oxaliplatiny a dávkování pegylovaného lipozomálního irinotekanu při podávání po léčbě založené na gemcitabinu. Pegylovaný lipozomální irinotekan byl podáván v dávce 50 mg/m2, 5‑fluorouracil 2 400 mg/m2, leukovorin 400 mg/m2 a oxaliplatina 60 mg/m2.) Komparátorem byl režim nab‑paklitaxel s gemcitabinem. Celkové přežití dosáhlo u NALIRIFOX 11,1 měsíce, v kontrolním rameni to bylo 9,2 měsíce (HR 0,84).
„Tato studie probíhala i na našem pracovišti. Režim NALIRIFOX by mohl být novým standardem léčby první linie, což zatím není. Tato terapeutická možnost je výhodná i díky jednoduchosti a relativní bezpečnosti. Toxicita je zvládnutelná, zvláště pokud využijeme všech možností podpůrné léčby a správně edukujeme pacienta.“
I zde cestu dopředu otevírá personalizovaná medicína. MUDr. John se proto věnoval potenciálu cílené terapie v závislosti na přítomnosti konkrétní aberace.
Připomněl americký projekt Poznej svůj tumor (Know Your Tumor) [8]. V jeho rámci bylo mezi 1 856 pacienty s karcinomem pankreatu identifikováno 26 procent nemocných s cílitelnou mutací. Pokud se jim dostalo cílené léčby, byl medián přežití 2,58 roku, při standardním postupu to bylo 1,51 roku (HR 0,42; 95% CI 0,26–0,68, p = 0,0004).
Podobně zaměřený evropský projekt s 342 pacienty tento výsledek potvrdil [9]. Nutnost sekvenování nové generace se etabluje i v guidelines, včetně Modré knihy. V té se uvádí: „U všech pacientů je doporučena vstupní genetická konzultace a vyšetření známých hereditárních syndromů včetně mutace BRCA1 a BRCA2. Testování somatického genového profilu by mělo být zváženo v případech, kde by jejich identifikace mohla ovlivnit systémovou léčbu, zejména u pokročilého onemocnění a v případě KRAS wild type tumorů (fúze NTRK, somatické mutace BRCA1/2, mikrosatelitní nestabilita, případně další).“ I když zatím z takového přístupu profitují spíše jednotliví pacienti, jde podle MUDr. Johna o krok kupředu, který jen podtrhuje důležitost a roli multidisciplinárních týmů.
Nejčastější aberací u metastatického karcinomu pankreatu je mutace KRAS. Klinickými studiemi nyní postupují například ireverzibilní inhibitory proteinu KRASG12C sotorasib nebo adagrasib. „Testovány jsou i tzv. multiRAS inhibitory, což by právě u karcinomu pankreatu mohlo mít velký potenciál, protože spektrum mutací RAS je zde velmi široké,“ komentoval MUDr. John.
V klinickém hodnocení jsou vedle celé řady dalších cílených látek i kombinace režimu NALIRIFOX se selektivním inhibitorem PLK‑1 onvansertibem v první linii pokročilého onemocnění, inhibitorem EGFR nimotuzumabem u lokálně pokročilého nádoru nebo s inhibitorem PD‑1 camrelizumabem u hraničně resekabilního nádoru.
U cholangiokarcinomu není s testováním prostřednictvím NGS na co čekat
Doc. MUDr. Michal Vočka, Ph.D., z Onkologické kliniky 1. LF UK a VFN v druhé části sympozia obrátil pozornost auditoria k cholangiokarcinomu. Ten představuje méně než jedno procento všech karcinomů, jde tedy o vzácné onemocnění [10,11]. Z jiného úhlu pohledu ale lze říci, že se jedná o druhý nejčastější primární nádor jater, který tvoří 10 až 15 procent všech hepatobiliárních malignit [12]. Křivky incidence a mortality jsou v tomto případě také velmi blízko, podobně jako u karcinomu pankreatu. „Minimum pacientů s metastatickým onemocněním přežije pět let. Z naší klinické praxe nevím o žádném pacientovi s prokazatelně metastatickým cholangiokarcinomem, který by pět let přežil,“ uvedl doc. Vočka.
Většina pacientů, přibližně 70 procent, přichází pozdě, kdy již nádor nelze operovat. A i z těch, kteří chirurgický výkon a adjuvantní léčbu podstoupili, dvě třetiny zrelabují.
Léčba první linie je standardně založena na chemoterapii gemcitabin plus cisplatina. Po progresi je však jen minimum možností pro léčbu 2. linie.
Na druhou stranu cholangiokarcinom je onemocněním s velkým potenciálem pro uplatnění personalizované, respektive tumor agnostické terapie. Až polovina pacientů může mít léčebně targetovatelnou mutaci. Z nich jsou nejběžnější mutace IDH1 a FGFR2, které společně představují až 40 procent případů cholangiokarcinomu [13,14,15,16].
Aby byly tyto změny odhaleny, mělo by být provedeno vyšetření NGS. Podle doporučení ESMO 2023 by molekulární analýza měla být provedena před zahájením nebo v průběhu 1. linie léčby, aby bylo možné co nejdříve vyhodnotit možnosti 2. a vyšších linií léčby u pokročilého onemocnění. Testování mutace IDH1 má být součástí genového panelu. Formulace v Modré knize ČOS zní takto: „Vzhledem k vysoké variabilitě molekulárních prediktorů a vzácnosti onemocnění je indikováno testování NGS. Výsledek testování může v případě prokázání ‚targetovatelných‘ mutací zásadně ovlivnit výběr léčby do 2. linie.“
Prediktivní testování somatických mutací metodou NGS je v ČR dostupné od roku 2021 a je hrazeno z prostředků veřejného zdravotního pojištění. Dělají je vybraná pracoviště ze sítě referenčních laboratoří patologie pro prediktivní testování. Výkon je prováděn výhradně na základě indikace multidisciplinárního indikačního semináře komplexního onkologického centra.
Nejblíže reálnému využití tohoto konceptu je ovlivnění mutace genu pro enzym izocitrátdehydrogenázu 1 (IDH1). Na tu je zacílen ivosidenib, který je dostupný i v České republice, byť zatím jen přes žádost o výjimečnou úhradu dle paragrafu 16. Jeho vstup do klinické praxe je dominantně založen na studii ClarlDHy, publikované v časopise Lancet Oncology [17,18]. Šlo o multicentrickou, randomizovanou, dvojitě zaslepenou a placebem kontrolovanou studii fáze III. Vstoupili do ní pacienti s histologicky potvrzeným IDH1 mutovaným pokročilým cholangiokarcinomem. U všech nemocných již došlo k progresi na předchozí léčbě a byli v dobrém výkonnostním stavu. Celkem 185 pacientů bylo randomizovaně rozděleno v poměru 2 : 1 buď k podávání ivosidenibu, nebo placeba. Design studie povoloval přechod z placeba na ivosidenib po radiologickém potvrzení progrese.
Primárním cílovým parametrem bylo přežití bez progrese onemocnění. Zde byl dokumentován významný rozdíl ve prospěch ivosidenibu s poměrem rizik 0,37. Při léčbě ivosidenibem dosáhl medián PFS 2,7 měsíce, zatímco při využití placeba to bylo 1,4 měsíce (p < 0,0001). „Jde prakticky o zdvojnásobení. Na průběhu křivek vidíme, že jednotlivá ramena se rozejdou a zůstávají oddělena poměrně dlouhou dobu, to znamená, že je zde skupina pacientů, kteří z léčby profitují dlouhodobě,“ uvedl doc. Vočka.
Podobně dopadlo hodnocení celkového přežití, i to je při využití ivosidenibu ve srovnání s placebem (po úpravě cross‑over) dvojnásobné (10,3 vs. 5,1 měsíce). Tato data dále ukazují, že významná část pacientů (16 %) podstoupila léčbu ivosidenibem trvající déle než rok a většina pacientů (92 %) léčených ivosidenibem po dobu více než jednoho roku žila po dvou letech [19]. Zatím však nejsou známy prediktory spojené s takovou dlouhodobou odpovědí na ivosidenib. Jediným důležitým parametrem se ukázala časnost intervence ivosidenibem, protože pouze pacienti, kteří zahájili léčbu včas, dosáhli maximální klinické odpovědi na léčbu.
Tento výsledek přitom není za cenu významné toxicity. Ivosidenib vyvolává ve srovnání s placebem méně nežádoucích účinků vedoucích k přerušení léčby, mírně více se na této léčbě vyskytuje nevolností a anémie.
Na hodnocení toho, s jakými výsledky probíhá léčba ivosidenibem v reálné české klinické praxi, je podle doc. Vočky ještě brzy. V tuzemských centrech bylo nebo je takto léčeno 13 pacientů. I tyto první zkušenosti ale ukazují na významný přínos této cílené léčby pro pacienty s cholangiokarcinomem. „Pokud máme potvrzenu mutaci IDH1, je nutné ivosidenib podat včas, aby se maximalizovala šance na co nejdelší pozitivní klinickou odpověď,“ zdůraznil doc. Vočka.
Reference:
1. Conroy T, Pfeiffer P, Vilgrain V, et al.; ESMO Guidelines Committee. Pancreatic cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow‑up. Ann Oncol. 2023;34(11):987–1002.
2. Ohba A, Ozaka M, Ogawa G, et al. 1616O Nab‑paclitaxel plus gemcitabine versus modified FOLFIRINOX or S‑IROX in metastatic or recurrent pancreatic cancer (JCOG1611, GENERATE): A multicentred, randomized, open‑label, three‑arm, phase II/III trial. Ann Oncol. 2023;34(Suppl 2):S894.
3. Knox JJ, Jaffee EM, O’Kane GM, et al. Early results of the PASS‑01 trial: Pancreatic adenocarcinoma signature stratification for treatment‑01. J Clin Oncol. 2024;42(17 Suppl):LBA4004.
4. Nichetti F, Rota S, Ambrosini P, et al. NALIRIFOX, FOLFIRINOX, and Gemcitabine With Nab‑Paclitaxel as First‑Line Chemotherapy for Metastatic Pancreatic Cancer: A Systematic Review and Meta‑Analysis. JAMA Netw Open. 2024;7(1):e2350756.
5. Wang‑Gillam A, Hubner RA, Siveke JT, et al. NAPOLI‑1 phase 3 study of liposomal irinotecan in metastatic pancreatic cancer: Final overall survival analysis and characteristics of long‑term survivors. Eur J Cancer. 2019;108:78–87.
6. Ueno M, Yoo C, Macarulla Mercade T, et al. 1519P – Real‑world evidence on long‑term survivors of metastatic pancreatic ductal adenocarcinoma (mPDAC) previously treated with liposomal irinotecan: NALLONG study. Ann Oncol. 2024;35(Suppl 2):S923–S936.
7. Wainberg ZA, Melisi D, Macarulla T, et al. NALIRIFOX versus nab‑paclitaxel and gemcitabine in treatment‑naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open‑label, phase 3 trial. Lancet. 2023;402(10409):1272–1281.
8. Pishvaian MJ, Blais EM, Brody JR, et al. Overall survival in patients with pancreatic cancer receiving matched therapies following molecular profiling: a retrospective analysis of the Know Your Tumor registry trial. Lancet Oncol. 2020;21(4):508–518.
9. Tarabay A, Boileve A, Smolenski C, et al. 340P – Molecular profiling in pancreatic cancers: Therapeutic and prognostic impact. Ann Oncol. 2024;35(Suppl 1):S119–S161.
10. Banales JM, Marin JJG, Lamarca A, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol. 2020;17(9):557–588.
11. Valle JW, Borbath I, Khan SA, et al.; ESMO Guidelines Committee. Biliary cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol. 2016;27(Suppl 5):v28–v37.
12. Bergquist A, von Seth E. Epidemiology of cholangiocarcinoma. Best Pract Res Clin Gastroenterol. 2015;29(2):221–232.
13. Vogel A, Bridgewater J, Edeline J, et al.; ESMO Guidelines Committee. Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow‑up. Ann Oncol. 2023;34(2):127–140.
14. Kendre G, Murugesan K, Brummer T, et al. Charting co‑mutation patterns associated with actionable drivers in intrahepatic cholangiocarcinoma. J Hepatol. 2023;78(3):614–626.
15. Lamarca A, Barriuso J, McNamara MG, et al. Molecular targeted therapies: Ready for “prime time” in biliary tract cancer. J Hepatol. 2020;73(1):170–185.
16. Mirallas O, López‑Valbuena D, García‑Illescas D, et al. Advances in the systemic treatment of therapeutic approaches in biliary tract cancer. ESMO Open. 2022;7(3):100503.
17. Abou‑Alfa GK, Macarulla T, Javle MM, et al. Ivosidenib in IDH1‑mutant, chemotherapy‑refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double‑blind, placebo‑controlled, phase 3 study. Lancet Oncol. 2020;21(6):796–807.
18. Zhu AX, Macarulla T, Javle MM, et al. Final Overall Survival Efficacy Results of Ivosidenib for Patients With Advanced Cholangiocarcinoma With IDH1 Mutation: The Phase 3 Randomized Clinical ClarIDHy Trial. JAMA Oncol. 2021;7(11):1669–1677.
19. Abou‑Alfa GK et al. Characterization of IDH‑1 mutant cholangiocarcinoma patients who received ivosidenib treatment longer than a year. SITC Poster V7. Presented at Cholangiocarcinoma Foundation 2023, Salt Lake City, USA.