Empagliflozin – léčba ovlivňující nejen prognózu srdečního selhání
Chronické srdeční selhání se stává závažnou zdravotní hrozbou, kterou je možné, podobně jako třeba obezitu nebo diabetes 2. typu, považovat za epidemii začátku 21. století. Za 16 let by podle predikcí ÚZIS ČR mělo v Česku být téměř 900 000 pacientů se srdečním selháním, a to vlivem stárnutí populace, nárůstu obezity, ale i lepší diagnostiky. Ještě nedávno přitom nebylo možné zásadněji ovlivnit neblahou trajektorii tohoto onemocnění. Dnes to možné je, klíčovými „game‑changery“ napříč úrovněmi ejekční frakce se staly inhibitory SGLT‑2.
 Na listopadové XXVII. konferenci České asociace srdečního selhání v Brně nemohla chybět odborná sdělení věnující se managementu chronického srdečního selhání (SS). MUDr. Jiří Veselý z EDUMED s. r. o. připomněl znění doporučených postupů pro diagnostiku a léčbu akutního a chronického SS z pera Evropské kardiologické společnosti (ESC) z roku 2012 a 2016. Tehdejší armamentárium pro léčbu chronického SS se sníženou ejekční frakcí (HFrEF) zahrnovalo diuretika, inhibitory ACE, betablokátory, antagonisty mineralokortikoidních receptorů (MRA) či ivabradin. V roce 2021 se první linie přeskupila a obohatila o nové účinné léky. Management se dnes opírá o základní čtyřku, jejíž nasazení snižuje mortalitu pacientů se SS – inhibitory ACE/sartany, betablokátory, MRA, inhibitory SGLT‑2 a kličková diuretika při retenci tekutin (McDonagh et al., Eur Heart J 2021). Podkladem pro pozici inhibitorů SGLT‑2, resp. empagliflozinu v léčbě HFrEF byly zcela přesvědčivé výsledky studie EMPEROR‑Reduced (Packer et al., NEJM 2020), která zkoumala účinek empagliflozinu ve srovnání s placebem na výskyt kardiovaskulární (KV) mortality a hospitalizací pro SS u pacientů s HFrEF. „Relativní riziko primárního cíle pokleslo o signifikantních 25 procent a počet pacientů, které je nutné léčit, aby se zabránilo jedné příhodě, tedy NNT, byl 19,“ shrnul MUDr. Veselý a dodal, že uvedená studie prokázala rovněž benefit empagliflozinu pro ledvinné funkce – výskyt kompozitního renálního cílového ukazatele (konečné stadium renálního selhání nebo významný pokles eGFR) poklesl ve srovnání s placebem o impresivních 50 procent. V již zmíněných doporučených postupech z roku 2021 si tak inhibitory SGLT‑2 vysloužily nejvyšší úroveň doporučení (IA) pro léčbu pacientů s HFrEF s cílem snížit jejich mortalitu a riziko hospitalizace pro SS. MUDr. Veselý připomněl, že se rozeznává několik fenotypů SS v závislosti na vyvolávající příčině, jako je např. hypertenze, chronické onemocnění ledvin nebo fibrilace síní (Rosano et al., Eur J Heart Fail 2021). Podstatné je, že glifloziny mají místo u všech těchto fenotypů SS. „Nová doporučení přinesla i další podstatnou změnu v terapii srdečního selhání se sníženou ejekční frakcí, a tou je požadavek na souběžné nasazení základních léků a jejich rychlou titraci na optimální dávky,“ zdůraznil MUDr. Veselý s odkazem na autory McMurraye a Packera (Circulation 2021), kteří navrhují v prvním kroku nasazení inhibitoru SGLT‑2 s betablokátorem a poté přidání ARNI a v třetím kroku MRA, to vše do čtyř týdnů, a následnou titraci k cílovým dávkám. Pacienti se SS jsou v drtivé většině polymorbidní pacienti, proto je v kontextu managementu SS zásadní, že inhibitory SGLT‑2 představují terapii bezpečnou. Studie EMPEROR‑Reduced ukázala, že ve srovnání s placebem empagliflozin významně nezvyšuje výskyt symptomatické hypotenze ani výskyt hypokalémie či hyperkalémie (bez ohledu na užívání MRA). Další data důležitá pro klinickou praxi vydala subanalýza studie EMPEROR‑Reduced (Filippatos et al., Eur J Heart Fail 2022), která ukázala, že empagliflozin zlepšuje KV výsledky napříč věkovými kategoriemi pacientů, kteří byli zahrnuti do studie EMPEROR‑Reduced.
Na listopadové XXVII. konferenci České asociace srdečního selhání v Brně nemohla chybět odborná sdělení věnující se managementu chronického srdečního selhání (SS). MUDr. Jiří Veselý z EDUMED s. r. o. připomněl znění doporučených postupů pro diagnostiku a léčbu akutního a chronického SS z pera Evropské kardiologické společnosti (ESC) z roku 2012 a 2016. Tehdejší armamentárium pro léčbu chronického SS se sníženou ejekční frakcí (HFrEF) zahrnovalo diuretika, inhibitory ACE, betablokátory, antagonisty mineralokortikoidních receptorů (MRA) či ivabradin. V roce 2021 se první linie přeskupila a obohatila o nové účinné léky. Management se dnes opírá o základní čtyřku, jejíž nasazení snižuje mortalitu pacientů se SS – inhibitory ACE/sartany, betablokátory, MRA, inhibitory SGLT‑2 a kličková diuretika při retenci tekutin (McDonagh et al., Eur Heart J 2021). Podkladem pro pozici inhibitorů SGLT‑2, resp. empagliflozinu v léčbě HFrEF byly zcela přesvědčivé výsledky studie EMPEROR‑Reduced (Packer et al., NEJM 2020), která zkoumala účinek empagliflozinu ve srovnání s placebem na výskyt kardiovaskulární (KV) mortality a hospitalizací pro SS u pacientů s HFrEF. „Relativní riziko primárního cíle pokleslo o signifikantních 25 procent a počet pacientů, které je nutné léčit, aby se zabránilo jedné příhodě, tedy NNT, byl 19,“ shrnul MUDr. Veselý a dodal, že uvedená studie prokázala rovněž benefit empagliflozinu pro ledvinné funkce – výskyt kompozitního renálního cílového ukazatele (konečné stadium renálního selhání nebo významný pokles eGFR) poklesl ve srovnání s placebem o impresivních 50 procent. V již zmíněných doporučených postupech z roku 2021 si tak inhibitory SGLT‑2 vysloužily nejvyšší úroveň doporučení (IA) pro léčbu pacientů s HFrEF s cílem snížit jejich mortalitu a riziko hospitalizace pro SS. MUDr. Veselý připomněl, že se rozeznává několik fenotypů SS v závislosti na vyvolávající příčině, jako je např. hypertenze, chronické onemocnění ledvin nebo fibrilace síní (Rosano et al., Eur J Heart Fail 2021). Podstatné je, že glifloziny mají místo u všech těchto fenotypů SS. „Nová doporučení přinesla i další podstatnou změnu v terapii srdečního selhání se sníženou ejekční frakcí, a tou je požadavek na souběžné nasazení základních léků a jejich rychlou titraci na optimální dávky,“ zdůraznil MUDr. Veselý s odkazem na autory McMurraye a Packera (Circulation 2021), kteří navrhují v prvním kroku nasazení inhibitoru SGLT‑2 s betablokátorem a poté přidání ARNI a v třetím kroku MRA, to vše do čtyř týdnů, a následnou titraci k cílovým dávkám. Pacienti se SS jsou v drtivé většině polymorbidní pacienti, proto je v kontextu managementu SS zásadní, že inhibitory SGLT‑2 představují terapii bezpečnou. Studie EMPEROR‑Reduced ukázala, že ve srovnání s placebem empagliflozin významně nezvyšuje výskyt symptomatické hypotenze ani výskyt hypokalémie či hyperkalémie (bez ohledu na užívání MRA). Další data důležitá pro klinickou praxi vydala subanalýza studie EMPEROR‑Reduced (Filippatos et al., Eur J Heart Fail 2022), která ukázala, že empagliflozin zlepšuje KV výsledky napříč věkovými kategoriemi pacientů, kteří byli zahrnuti do studie EMPEROR‑Reduced.
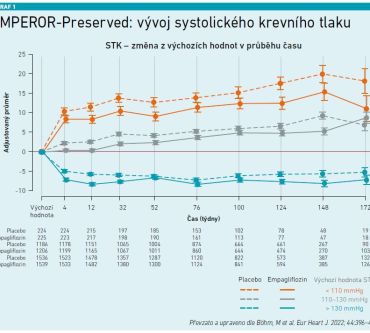
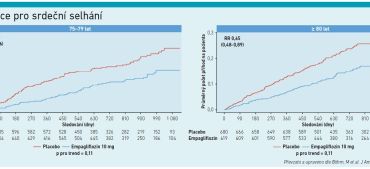 Pokud jde o SS se zachovanou ejekční frakcí (HFpEF), nebyla do příchodu inhibitorů SGLT‑2, resp. do získání výsledků studie EMPEROR‑Preserved (Anker et al., NEJM 2021) k dispozici terapie, která by snižovala morbiditu a mortalitu pacientů s HFpEF. Dodejme, že asi polovina ze všech pacientů se SS má právě zachovanou nebo mírně sníženou ejekční frakci (HFmrEF). Studie EMPEROR‑Preserved zahrnula pacienty s třídou NYHA II–IV a ejekční frakci levé komory (EF LK) vyšší než 40 procent. Během 36 měsíců vedla léčba empagliflozinem k signifikantnímu snížení výskytu KV úmrtí či hospitalizace pro srdeční selhání o 21 procent ve srovnání s placebem a NNT bylo 31. Díky těmto výsledkům bylo možné inhibitory SGLT‑2 zahrnout do aktualizace doporučených postupů ESC v roce 2023 (McDonagh et al., Eur Heart J 2023). Inhibitory SGLT‑2 zde stojí v hierarchii léčby nejvýše (úroveň důkazů IA) a jsou doporučeny pro léčbu pacientů s HFmrEF (EF LK 41–49 %) a HFpEF (EF LK ≥ 50 %) pro redukci rizika KV mortality a hospitalizací pro HF. U pacientů s HFmrEF a HFpEF se ve třídě důkazů I nacházejí ještě diuretika pro léčbu retence tekutin a u HFpEF je navíc podtrhnuta léčba etiologických příčin SS a KV a non‑KV komorbidit. Jak podtrhnul MUDr. Veselý, EMPEROR‑Preserved ukázala, jak je zlepšení primárního cílového ukazatele ovlivněno počátečním systolickým krevním tlakem (STK) – ve skupině pacientů s nižším výchozím STK (< 110 mm Hg) byl zaznamenán vyšší výskyt KV komplikací a kratší doba do první hospitalizace kvůli SS nebo do úmrtí z KV příčin. Léčba empagliflozinem přinesla pozitivní výsledky bez ohledu na výchozí hodnotu TK, sníženo bylo riziko KV komplikací a současně se nezvyšovalo riziko hypotenze či hypovolémie. Hypertenze je velmi častou komorbiditou pacientů s HFpEF (52 procent), u nemocných HFrEF se oproti tomu vyskytuje méně často (28,2 % podle studie EMPEROR‑Reduced). „Pacienti se systolickým krevním tlakem pod 110 mm Hg mají obecně horší prognózu srdečního selhání, bývají však často nedostatečně léčeni právě kvůli absenci hypertenze,“ podotkl MUDr. Veselý. Podle popsaných dat však nelze považovat výchozí hodnotu STK za faktor modifikující kardiorenální účinnost a mechanismus účinku empagliflozinu, jeho efekt je zachován i při TK < 110 mm Hg. Nízký STK by podle autorů neměl být překážkou pro zahájení léčby empagliflozinem u pacientů se srdečním selháním a EF LK > 40 % (viz graf 1). I u pacientů s HFpEF se potvrdilo, že empagliflozin zlepšuje výsledky pacientů bez ohledu na věk (Böhm et al., J Am Coll Cardiol 2022) (viz graf 2). „Pokud vezmeme v úvahu pouze pacienty užívající placebo, výskyt primárních výsledných parametrů a kardiovaskulárních onemocnění se zvyšoval s věkem. Empagliflozin snižoval primární výsledky a výskyt prvního a recidivujícího kardiovaskulárního onemocnění ve všech věkových skupinách, přičemž účinek byl podobný ve věku nad 75 let a nad 80 let,“ shrnul MUDr. Veselý a doplnil, že empagliflozin zlepšil v 52. týdnu Kansas City Cardiomyopathy Questionnaire‑Clinical Summary (KCCQ) Score a zmírnil pokles odhadované glomerulární filtrace bez interakce s věkem. Důležité bylo i to, že mezi empagliflozinem a placebem nebyly napříč věkovými skupinami zjištěny žádné klinicky relevantní rozdíly v nežádoucích příhodách. MUDr. Veselý také zmínil, že studie EMPA‑Kidney (Herrington et al., NEJM 2023) ukázala, že pacienti s diabetickou nebo nediabetickou nefropatií léčení empagliflozinem mají signifikantně nižší riziko progrese chronického onemocnění ledvin (CKD) nebo KV úmrtí, a to o 28 procent. Díky přesvědčivým datům ze studie EMPA‑Kidney došlo s platností od června letošního roku k rozšíření již hrazených indikací emapgliflozinu (které měl doposud pro léčbu dospělých s nedostatečně kontrolovaným diabetem 2. typu a pro léčbu dospělých se symptomatickým chronickým SS), a to pro léčbu dospělých s CKD. Důležité je zmínit i úhradové podmínky empagliflozinu – v indikacích diabetes 2. typu, SS a CKD jej může předepisovat diabetolog a endokrinolog, kardiolog a internista (nefrolog pak v indikaci CKD). U pacientů s CKD bez diabetu do GF 45 ml/min není třeba sledovat UACR (poměr albumin/kreatinin v moči), nad tuto hodnotu pak ano. U pacientů s CKD i diabetem je hranice eGFR 75 ml/min/1,73 m2. „Měli bychom pamatovat na to, že prevalence albuminurie u diabetiků ve věkové skupině nad 65 let činí 35 až 40 procent. Je proto třeba u těchto nemocných albuminurii vyšetřovat,“ nabádal MUDr. Veselý. Podle něj se tak ale v praxi dostatečně neděje. Americká studie ADD‑CKD (Satzech, PlosOne 2014) zahrnula 9 000 pacientů z 500 praxí praktických lékařů nebo diabetologů. V rámci studie bylo u těchto pacientů provedeno jednorázové vyšetření renálních funkcí (eGFR a UACR). Celkem 5 000 pacientů z celkového počtu 9 000 mělo CKD. Investigátoři se následně podívali do dokumentace – jen asi 12 procent těchto pacientů mělo diagnózu CKD uvedenu ve své dokumentaci, 88 procent nikoli. „Nejhůře na tom byli pacienti s počátečními a lehčími stadii CKD. Měli bychom tedy kromě kardiologických diagnóz a diabetu 2. typu sledovat i ledviny a snažit se určit příčinu poškození jejich funkce. Měli bychom také do dokumentace důsledně zapsat výši eGFR a UACR,“ apeloval MUDr. Veselý, protože evropská realita je podle něj velmi podobně neuspokojivá, jak ukázala recentní studie z Německa (Wanner et al., 2024). Nová doporučení ESC pro léčbu hypertenze (McEwoy et al., Eur Heart J 2024) nabádají k rutinnímu stanovení renálních funkcí (eGFR i UACR). Pokud by pacient měl středně závažné nebo závažné CKD (eGFR pod 60 ml/min/1,73 m2 nebo albuminurie 3 mg/mmol nebo více), je doporučeno opakovat měření sérové koncentrace kreatininu, eGFR a UACR aspoň každoročně (úroveň důkazů IC). Tyto guidelines také doporučují s úrovní důkazů IA, že u pacientů s hypertenzí, CKD a eGFR nad 20 ml/min/1,73 m2 by měly být podány inhibitory SGLT‑2.
Pokud jde o SS se zachovanou ejekční frakcí (HFpEF), nebyla do příchodu inhibitorů SGLT‑2, resp. do získání výsledků studie EMPEROR‑Preserved (Anker et al., NEJM 2021) k dispozici terapie, která by snižovala morbiditu a mortalitu pacientů s HFpEF. Dodejme, že asi polovina ze všech pacientů se SS má právě zachovanou nebo mírně sníženou ejekční frakci (HFmrEF). Studie EMPEROR‑Preserved zahrnula pacienty s třídou NYHA II–IV a ejekční frakci levé komory (EF LK) vyšší než 40 procent. Během 36 měsíců vedla léčba empagliflozinem k signifikantnímu snížení výskytu KV úmrtí či hospitalizace pro srdeční selhání o 21 procent ve srovnání s placebem a NNT bylo 31. Díky těmto výsledkům bylo možné inhibitory SGLT‑2 zahrnout do aktualizace doporučených postupů ESC v roce 2023 (McDonagh et al., Eur Heart J 2023). Inhibitory SGLT‑2 zde stojí v hierarchii léčby nejvýše (úroveň důkazů IA) a jsou doporučeny pro léčbu pacientů s HFmrEF (EF LK 41–49 %) a HFpEF (EF LK ≥ 50 %) pro redukci rizika KV mortality a hospitalizací pro HF. U pacientů s HFmrEF a HFpEF se ve třídě důkazů I nacházejí ještě diuretika pro léčbu retence tekutin a u HFpEF je navíc podtrhnuta léčba etiologických příčin SS a KV a non‑KV komorbidit. Jak podtrhnul MUDr. Veselý, EMPEROR‑Preserved ukázala, jak je zlepšení primárního cílového ukazatele ovlivněno počátečním systolickým krevním tlakem (STK) – ve skupině pacientů s nižším výchozím STK (< 110 mm Hg) byl zaznamenán vyšší výskyt KV komplikací a kratší doba do první hospitalizace kvůli SS nebo do úmrtí z KV příčin. Léčba empagliflozinem přinesla pozitivní výsledky bez ohledu na výchozí hodnotu TK, sníženo bylo riziko KV komplikací a současně se nezvyšovalo riziko hypotenze či hypovolémie. Hypertenze je velmi častou komorbiditou pacientů s HFpEF (52 procent), u nemocných HFrEF se oproti tomu vyskytuje méně často (28,2 % podle studie EMPEROR‑Reduced). „Pacienti se systolickým krevním tlakem pod 110 mm Hg mají obecně horší prognózu srdečního selhání, bývají však často nedostatečně léčeni právě kvůli absenci hypertenze,“ podotkl MUDr. Veselý. Podle popsaných dat však nelze považovat výchozí hodnotu STK za faktor modifikující kardiorenální účinnost a mechanismus účinku empagliflozinu, jeho efekt je zachován i při TK < 110 mm Hg. Nízký STK by podle autorů neměl být překážkou pro zahájení léčby empagliflozinem u pacientů se srdečním selháním a EF LK > 40 % (viz graf 1). I u pacientů s HFpEF se potvrdilo, že empagliflozin zlepšuje výsledky pacientů bez ohledu na věk (Böhm et al., J Am Coll Cardiol 2022) (viz graf 2). „Pokud vezmeme v úvahu pouze pacienty užívající placebo, výskyt primárních výsledných parametrů a kardiovaskulárních onemocnění se zvyšoval s věkem. Empagliflozin snižoval primární výsledky a výskyt prvního a recidivujícího kardiovaskulárního onemocnění ve všech věkových skupinách, přičemž účinek byl podobný ve věku nad 75 let a nad 80 let,“ shrnul MUDr. Veselý a doplnil, že empagliflozin zlepšil v 52. týdnu Kansas City Cardiomyopathy Questionnaire‑Clinical Summary (KCCQ) Score a zmírnil pokles odhadované glomerulární filtrace bez interakce s věkem. Důležité bylo i to, že mezi empagliflozinem a placebem nebyly napříč věkovými skupinami zjištěny žádné klinicky relevantní rozdíly v nežádoucích příhodách. MUDr. Veselý také zmínil, že studie EMPA‑Kidney (Herrington et al., NEJM 2023) ukázala, že pacienti s diabetickou nebo nediabetickou nefropatií léčení empagliflozinem mají signifikantně nižší riziko progrese chronického onemocnění ledvin (CKD) nebo KV úmrtí, a to o 28 procent. Díky přesvědčivým datům ze studie EMPA‑Kidney došlo s platností od června letošního roku k rozšíření již hrazených indikací emapgliflozinu (které měl doposud pro léčbu dospělých s nedostatečně kontrolovaným diabetem 2. typu a pro léčbu dospělých se symptomatickým chronickým SS), a to pro léčbu dospělých s CKD. Důležité je zmínit i úhradové podmínky empagliflozinu – v indikacích diabetes 2. typu, SS a CKD jej může předepisovat diabetolog a endokrinolog, kardiolog a internista (nefrolog pak v indikaci CKD). U pacientů s CKD bez diabetu do GF 45 ml/min není třeba sledovat UACR (poměr albumin/kreatinin v moči), nad tuto hodnotu pak ano. U pacientů s CKD i diabetem je hranice eGFR 75 ml/min/1,73 m2. „Měli bychom pamatovat na to, že prevalence albuminurie u diabetiků ve věkové skupině nad 65 let činí 35 až 40 procent. Je proto třeba u těchto nemocných albuminurii vyšetřovat,“ nabádal MUDr. Veselý. Podle něj se tak ale v praxi dostatečně neděje. Americká studie ADD‑CKD (Satzech, PlosOne 2014) zahrnula 9 000 pacientů z 500 praxí praktických lékařů nebo diabetologů. V rámci studie bylo u těchto pacientů provedeno jednorázové vyšetření renálních funkcí (eGFR a UACR). Celkem 5 000 pacientů z celkového počtu 9 000 mělo CKD. Investigátoři se následně podívali do dokumentace – jen asi 12 procent těchto pacientů mělo diagnózu CKD uvedenu ve své dokumentaci, 88 procent nikoli. „Nejhůře na tom byli pacienti s počátečními a lehčími stadii CKD. Měli bychom tedy kromě kardiologických diagnóz a diabetu 2. typu sledovat i ledviny a snažit se určit příčinu poškození jejich funkce. Měli bychom také do dokumentace důsledně zapsat výši eGFR a UACR,“ apeloval MUDr. Veselý, protože evropská realita je podle něj velmi podobně neuspokojivá, jak ukázala recentní studie z Německa (Wanner et al., 2024). Nová doporučení ESC pro léčbu hypertenze (McEwoy et al., Eur Heart J 2024) nabádají k rutinnímu stanovení renálních funkcí (eGFR i UACR). Pokud by pacient měl středně závažné nebo závažné CKD (eGFR pod 60 ml/min/1,73 m2 nebo albuminurie 3 mg/mmol nebo více), je doporučeno opakovat měření sérové koncentrace kreatininu, eGFR a UACR aspoň každoročně (úroveň důkazů IC). Tyto guidelines také doporučují s úrovní důkazů IA, že u pacientů s hypertenzí, CKD a eGFR nad 20 ml/min/1,73 m2 by měly být podány inhibitory SGLT‑2.