Cílem léčby polycythaemia vera je regrese biologické podstaty onemocnění
Polycythaemia vera (PV) je chronické myeloproliferativní onemocnění s klonální proliferací pluripotentní kmenové buňky, která se diferencuje převážně do erytrocytární řady. Patofyziologicky za ní stojí různé mutace hlavně v genu pro Janusovu kinázu typu 2 (JAK2), které mohou rozvoji manifestního onemocnění předcházet o mnoho let. „Léčba PV se po dekády opírala především o venepunkce a hydroxyureu (HU). Převratem v její terapii byl příchod interferonů, jejichž nativní formy ale mají krátký biologický poločas. Postupně se tak přešlo na pegylaci interferonů a navázání na polyethylenglykol (PEG), jež tento problém řeší. Ukázalo se ale, že mezi způsoby pegylace panují značné rozdíly výsledné struktury, které se propisují do účinnosti i bezpečnosti léčby. Z tohoto pohledu se jako nejvýhodnější jeví ropeginterferon alfa‑2b, který se vyznačuje pegylací jen na jednom místě molekuly interferonu. Lék navíc, na rozdíl od starších léčebných možností, poskytuje potenciál modifikace průběhu choroby se snížením alelické nálože mutací genu JAK2,“ sdělila na letošním III. českém hematologickém a transfuziologickém sjezdu MUDr. Natália Podstavková z Interní hematologické a onkologické kliniky LF MU a FN Brno. Tuto část programu podpořila společnost AOP.
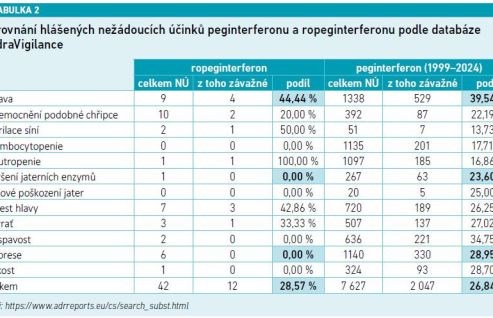
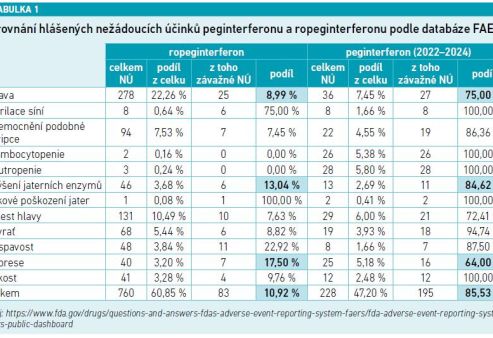 O nežádoucích účincích pegylovaných interferonů v závislosti na jejich trojrozměrné struktuře hovořil PharmDr. Josef Suchopár z Interakční akademie: „Pro léčbu PV jsou indikovány celkem tři molekuly – peginterferon alfa‑2a, peginterferon alfa‑2b a ropeginterferon alfa‑2b. Zatímco první dva jmenované mají několik vazebných míst pro PEG, a existují proto ve formě různých polohových izomerů s velmi odlišnou 3D strukturou, ropeginterferon alfa‑2b se vyznačuje pegylací na jednom místě se vznikem uniformního monomeru. Účinek polohových izomerů je přitom výsledkem průniku účinků jejich směsi, a výsledný efekt je tak hůře předvídatelný. Tento rozdíl vůbec není jen předmětem akademické debaty, naopak se značně propisuje do důsledků in vivo. Pro všechny látky jsou již dostupná poměrně obsáhlá farmakovigilanční data z hlášení nežádoucích účinků, která lze najít například v databázi americké FDA FAERS (viz tabulku 1) nebo evropské EMA EudraVigilance (viz tabulku 2). Ze všech hlášených nežádoucích účinků byl podíl těch závažných (takových, které zapříčiní ohrožení života nebo smrt pacienta, nutnost a prodloužení hospitalizace nebo trvalé poškození zdraví) v obou výše zmíněných databázích při porovnání srovnatelného období 2022–2024 výrazně nižší u pacientů léčených ropeginterferonem alfa‑2b (ve FAERS celkem 10,92 % závažných) než peginterferonem alfa‑2a (ve FAERS celkem 85,53 % závažných). Tato data odpovídají výsledkům klinických studií, ve kterých léčbu peginterferonem alfa‑2a ukončovala z důvodu nežádoucích účinků v průměru asi čtvrtina pacientů (u studie DALIAH až 65 % pacientů), u ropeginterferonu alfa‑2b to bylo jen průměrně deset procent. Kromě toho je rozdílná také dynamika ukončování terapie v čase, kdy u prvního jmenovaného po 36 měsících jeho míra prudce stoupá, u ropeginterferonu alfa‑2b je v čase konstantní. Kontraindikace obou látek jsou velmi podobné, jedná se vedle přecitlivělosti k přípravku zejména o dekompenzované onemocnění štítné žlázy, těžké psychiatrické choroby, autoimunitní onemocnění a těžké poruchy jater a ledvin,“ sdělil PharmDr. Josef Suchopár a dodal pár slov o interakcích těchto látek: „Všechny interferony bez výjimky snižují expresi CYP1A2, a prodlužují tak biologický poločas jeho substrátů. Mezi ně patří teofylin, lidokain, amiodaron, propranolol, estradiol, propofol nebo třeba karbamazepin.“
O nežádoucích účincích pegylovaných interferonů v závislosti na jejich trojrozměrné struktuře hovořil PharmDr. Josef Suchopár z Interakční akademie: „Pro léčbu PV jsou indikovány celkem tři molekuly – peginterferon alfa‑2a, peginterferon alfa‑2b a ropeginterferon alfa‑2b. Zatímco první dva jmenované mají několik vazebných míst pro PEG, a existují proto ve formě různých polohových izomerů s velmi odlišnou 3D strukturou, ropeginterferon alfa‑2b se vyznačuje pegylací na jednom místě se vznikem uniformního monomeru. Účinek polohových izomerů je přitom výsledkem průniku účinků jejich směsi, a výsledný efekt je tak hůře předvídatelný. Tento rozdíl vůbec není jen předmětem akademické debaty, naopak se značně propisuje do důsledků in vivo. Pro všechny látky jsou již dostupná poměrně obsáhlá farmakovigilanční data z hlášení nežádoucích účinků, která lze najít například v databázi americké FDA FAERS (viz tabulku 1) nebo evropské EMA EudraVigilance (viz tabulku 2). Ze všech hlášených nežádoucích účinků byl podíl těch závažných (takových, které zapříčiní ohrožení života nebo smrt pacienta, nutnost a prodloužení hospitalizace nebo trvalé poškození zdraví) v obou výše zmíněných databázích při porovnání srovnatelného období 2022–2024 výrazně nižší u pacientů léčených ropeginterferonem alfa‑2b (ve FAERS celkem 10,92 % závažných) než peginterferonem alfa‑2a (ve FAERS celkem 85,53 % závažných). Tato data odpovídají výsledkům klinických studií, ve kterých léčbu peginterferonem alfa‑2a ukončovala z důvodu nežádoucích účinků v průměru asi čtvrtina pacientů (u studie DALIAH až 65 % pacientů), u ropeginterferonu alfa‑2b to bylo jen průměrně deset procent. Kromě toho je rozdílná také dynamika ukončování terapie v čase, kdy u prvního jmenovaného po 36 měsících jeho míra prudce stoupá, u ropeginterferonu alfa‑2b je v čase konstantní. Kontraindikace obou látek jsou velmi podobné, jedná se vedle přecitlivělosti k přípravku zejména o dekompenzované onemocnění štítné žlázy, těžké psychiatrické choroby, autoimunitní onemocnění a těžké poruchy jater a ledvin,“ sdělil PharmDr. Josef Suchopár a dodal pár slov o interakcích těchto látek: „Všechny interferony bez výjimky snižují expresi CYP1A2, a prodlužují tak biologický poločas jeho substrátů. Mezi ně patří teofylin, lidokain, amiodaron, propranolol, estradiol, propofol nebo třeba karbamazepin.“
Rozdíly mezi pegylovanými interferony v praxi
 Rozdílům mezi pegylovanými interferony v klinické praxi se věnovala také MUDr. Natália Podstavková z FN Brno: „Interferony byly objeveny v 50. letech minulého století a původně se s nimi počítalo především v terapii virových onemocnění. Přirozeně se totiž jedná o jakési pěšáky imunitního systému, které mají za cíl zneškodnění cizích nox a označení okolí postižené buňky. Postupně se ale přišlo také na jejich účinky antiproliferační, imunomodulační a antiangiogenní. Jako první například prokázaly možnost dosažení indukce kompletní hematologické odpovědi (CHR) a cytogenetické remise u chronické myeloidní leukémie (CML), posléze i u myeloproliferací bez přítomnosti Philadelphského chromozomu (Ph–), mezi něž patří PV a dále esenciální trombocytémie (ET) a primární myelofibróza. Bohužel jejich širokému použití bránila nutnost častého parenterálního podávání několikrát týdně a omezující nežádoucí účinky. Tyto potíže se zdařilo částečně vyřešit právě pegylací, která umožňuje i v aktivní fázi léčby subkutánní podání jednou týdně nebo jednou za 14 dní. Ačkoli některé nežádoucí účinky přetrvávají i u pegylovaných přípravků, na rozdíl od donedávna široce používané HU nepůsobí genotoxicky, karcinogenně a leukemogenně. Zároveň se jedná o jedinou možnost cytoredukční léčby v graviditě, protože na rozdíl od alternativ nejsou teratogenní,“ sdělila a pokračovala: „Jejich obrovskou předností ale je, že nejenom že kontrolují hematokrit a zmírňují symptomy, ale také modifikují průběh onemocnění. Látky totiž snižují nálož JAK2 alelické nálože s potenciálem pro dosažení molekulární odpovědi až remise, a s tím také snižují riziko přechodu do sekundární myelofibrózy. Po tomto zjištění se jejich užití posunulo i do kategorie pacientů s PV označovanou jako low‑risk, která byla donedávna řešena většinou jen kyselinou acetylsalicylovou (ASA) a venepunkcemi.“
Rozdílům mezi pegylovanými interferony v klinické praxi se věnovala také MUDr. Natália Podstavková z FN Brno: „Interferony byly objeveny v 50. letech minulého století a původně se s nimi počítalo především v terapii virových onemocnění. Přirozeně se totiž jedná o jakési pěšáky imunitního systému, které mají za cíl zneškodnění cizích nox a označení okolí postižené buňky. Postupně se ale přišlo také na jejich účinky antiproliferační, imunomodulační a antiangiogenní. Jako první například prokázaly možnost dosažení indukce kompletní hematologické odpovědi (CHR) a cytogenetické remise u chronické myeloidní leukémie (CML), posléze i u myeloproliferací bez přítomnosti Philadelphského chromozomu (Ph–), mezi něž patří PV a dále esenciální trombocytémie (ET) a primární myelofibróza. Bohužel jejich širokému použití bránila nutnost častého parenterálního podávání několikrát týdně a omezující nežádoucí účinky. Tyto potíže se zdařilo částečně vyřešit právě pegylací, která umožňuje i v aktivní fázi léčby subkutánní podání jednou týdně nebo jednou za 14 dní. Ačkoli některé nežádoucí účinky přetrvávají i u pegylovaných přípravků, na rozdíl od donedávna široce používané HU nepůsobí genotoxicky, karcinogenně a leukemogenně. Zároveň se jedná o jedinou možnost cytoredukční léčby v graviditě, protože na rozdíl od alternativ nejsou teratogenní,“ sdělila a pokračovala: „Jejich obrovskou předností ale je, že nejenom že kontrolují hematokrit a zmírňují symptomy, ale také modifikují průběh onemocnění. Látky totiž snižují nálož JAK2 alelické nálože s potenciálem pro dosažení molekulární odpovědi až remise, a s tím také snižují riziko přechodu do sekundární myelofibrózy. Po tomto zjištění se jejich užití posunulo i do kategorie pacientů s PV označovanou jako low‑risk, která byla donedávna řešena většinou jen kyselinou acetylsalicylovou (ASA) a venepunkcemi.“
MUDr. Podstavková se opřela o doporučení pro léčbu PV od skupiny ELN z roku 2021. Ta zmiňují právě ASA a venepunkce u všech dosud k léčbě naivních pacientů s PV, dále je podle rizika rozvoje tromboembolické příhody dělí do tří skupin. Pacienty v nízkém riziku pod 60 let bez trombózy v osobní anamnéze je možné řešit bez cytoredukční léčby. Již u těch v nízkém riziku, kteří ovšem vykazují přídatné faktory, jako je intolerance venepunkcí, progredující splenomegalie, těžké konstituční příznaky nebo trombocytémie a leukocytóza, jsou doporučeny ropeginterferon alfa‑2b nebo peginterferon alfa‑2a, pegylované interferony jsou zde jedinou možností. U pacientů ve vysokém riziku je potom indikován buď pegylovaný interferon, nebo HU k cytoredukční léčbě.
Peginterferon alfa‑2a se podává pomocí podkožní injekce jednou týdně, dávka se postupně navyšuje a efekt se dostavuje v průběhu několika měsíců. Jeho účinnost a bezpečnost popsala například klinická studie III. fáze DALIAH, ve které byl u dosud k léčbě naivních pacientů srovnáván s hydroxyureou. Interferon dosáhl oproti HU signifikantní redukce JAK2 alelické nálože, dosažení kompletní hematologické odpovědi ale oproti HU statisticky rozdílné nebylo. Omezující byla také míra nežádoucích účinků. V 60. měsíci léčby mělo pegylovaný interferon vysazen celých 65 % pacientů (oproti 37 % s HU). Vážné nežádoucí účinky se přitom vyskytly u 45 % pacientů z interferonové větve. Právě nežádoucí účinky přitom pravděpodobně byly důvodem, proč byla studie z hlediska CHR neutrální, řada pacientů léčbu ukončila dříve, než se její účinek mohl plně projevit. Při subanalýze pouze těch pacientů, kteří na léčbě vydrželi, totiž docházelo v interferonové větvi k CHR i molekulární odpovědi signifikantně častěji než na HU. Podobně v jednoramenné studii MPD‑RC vedlo podávání peginterferonu alfa‑2a pacientům s PV a ET refrakterní k HU k častým CHR, toxicita se ale týkala asi 90 % souboru, grade 3 a vyšší skoro 45 %.
Naproti tomu ropeginterferon alfa‑2b byl prvním interferonem, který byl vyvinut speciálně pro terapii myeloproliferativních onemocnění a v ČR i celé EU má schválenu indikaci PV. Zároveň ale paradoxně nemá, na rozdíl od peginterferonu alfa‑2a, stanovenu úhradu, a jeho nasazení proto podléhá schválení revizním lékařem. Určen je pro léčbu dospělých pacientů s PV bez symptomatické splenomegalie. Výhodou je podávání jen jednou za 14 dní, v udržovací fázi jednou za čtyři týdny. Jeho vysoká efektivita na dosažení dlouhodobé CHR a molekulární odpovědi se snížením JAK2 alelické nálože byla oproti HU ověřena v klinických studiích PROUD PV a jejím prodloužení CONTINUATION PV, osvědčil se v nich i dávkovací režim. Do PROUD PV bylo zařazeno celkem 257 k léčbě dosud naivních pacientů (nebo krátce předléčených HU), v prodloužení jich pokračovalo 157. CHR sice po jednom roce dosáhlo 21 % pacientů na interferonu oproti 28 % na HU, v čase se ale křivky protnuly a ropeginterferon byl naopak superiorní (CHR po 5 letech 55,8 % vs. 44 %). Ještě důležitější je ale dosažení molekulární odpovědi po pěti letech – 69,1 % vs. 21,6 % s výrazným snížením JAK2 alelické nálože. CHR se udržela dlouhodobě, v 6. roce léčby nebylo nutné provádět venepunkce k udržení hematokritu pod 45 % u 81,4 % pacientů na ropeginterferonu alfa‑2b vs. u 60 % pacientů v kontrolním rameni. Závažné nežádoucí účinky byly i v aktivní větvi málo časté, jednotlivé skupiny se týkaly jednotek procent pacientů a málokdy vedly k přerušení terapie. To se navíc týkalo i pacientů starších 60 let, kteří jsou toxicitou zejména ohroženi.
Použití nízké dávky ropeginterferonu alfa‑2b u nízce rizikových pacientů s PV oproti prostému podávání ASA a venepunkcím porovnala multicentrická studie II. fáze Low‑PV. Primárního sledovaného parametru kompletní hematologické odpovědi v ní dosáhlo 84 % probandů na ropeginterferonu a jen 60 % v kontrolní větvi s venepunkcemi, hematokrit se povedlo udržet u 84 % vs. 66 % a k progresi onemocnění došlo u osmi procent kontrol, ale u žádného pacienta léčeného ropeginterferonem alfa‑2b. U signifikantně více pacientů s ropegIFN také ustoupil pruritus a noční pocení. Ke snížení JAK2 alelické nálože došlo u deseti procent pacientů s ropegIFN oproti jednomu procentu pacientů s venepunkcemi.
„To je zejména důležité, protože se jedná převážně o mladší pacienty, kteří budou s chorobou žít zpravidla celou řadu let, omezení progrese a ovlivnění biologie onemocnění je tak pro ně klíčové. Riziko progrese je přitom zcela reálné, po 24 měsících sledování progredovalo v kontrolní skupině celých 13 % pacientů. I ve studii Low‑PV byly vážné nežádoucí účinky ropeginterferonu alfa‑2b málo časté, nejčastěji se jednalo o neutropenii. Incidence toxicity grade 3 a vyšší nebyla mezi studijními větvemi signifikantně rozdílná,“ komentovala MUDr. Podstavková.
Odlišná struktura – odlišné vlastnosti
Přímé srovnání pegylovaných interferonů v jedné klinické studii dosud není k dispozici. Rozdíly v pegylaci a 3D struktuře molekul ale zcela zjevně vedou k rozdílným vlastnostem. Pegylované interferony alfa‑2a a alfa‑2b je nutné podávat jednou týdně, ropeginterferon alfa‑2b stačí aplikovat jednou za 14 dní, respektive v udržovací fázi jednou za čtyři týdny. Napříč klinickými studiemi také vykázal nižší míru nutnosti přerušení terapie pro nežádoucí účinky do 10 %, ve srovnání s 15–30 % ve studiích s pegylovaným interferonem alfa‑2a.
MUDr. Podstavková se zamyslela také nad možnosti převedení pacientů, kteří netolerují pegylovaný interferon alfa‑2a nebo u nich nemá dostatečný účinek, na ropeginterferon alfa‑2b: „Pro tento switch dosud neexistuje randomizovaná studie, v literatuře jsou ale dostupná kazuistická sdělení. Ta ukazují, že záměna skutečně může vést k snesitelnějšímu bezpečnostnímu profilu za současného udržení účinnosti a stabilních hodnot krevního obrazu. Dávku je potom vhodné zvolit tak, že se 4týdenní dávka původního pegylovaného interferonu alfa‑2a vynásobí koeficientem 0,7 a výsledek představuje 4týdenní dávku ropeginterferonu alfa‑2b, následovat případně může titrace na míru konkrétnímu pacientovi.“
Rozšíření ropeginterferonu alfa‑2b je v České republice zatím omezeno především nedostatečnými úhradovými podmínkami, na druhou stranu se již dostává i do běžné klinické praxe. V tomto smyslu přinesla MUDr. Podstavková data z české databáze MIND za období 1/2020–8/2024. Lék byl dosud použit u 83 nemocných, u osmi procent se jednalo o první linii cytoredukční terapie, u 34 % o druhou linii a u většiny až o třetí linii po selhání nebo intoleranci nejčastěji pegylovaného interferonu alfa‑2a a/nebo HU. „To odráží současnou suboptimální úhradovou situaci, kdy revizní lékař zpravidla ropeginterferon alfa‑2b neschválí bez vyčerpání jiných možností. Přitom důvodem pro přechod na ropeginterferon jsou dominantně nežádoucí účinky předchozí léčby, to se týká 48 % pacientů, u těch, kteří přecházejí z pegylovaného interferonu alfa‑2a, dokonce 89 %. Opět se tak ukazuje, že pegylovaný interferon alfa‑2a je sice efektivní, ale jeho použití limitují nežádoucí účinky. U ropeginterferonu alfa‑2b naproti tomu zaznamenalo nežádoucí účinky v průběhu terapie jen 17 % z těch, kdo na lék přešli z pegylovaného interferonu alfa‑2a, a ukončit léčbu muselo jen pět procent. V celém souboru z registru MIND potom na léčbě ropeginterferonem alfa‑2b zaznamenalo nežádoucí účinky 39 % pacientů, jednalo se ale především o grade 1 a 2. Nejčastější byly hepatopatie a neutropenie. Naproti tomu ve stejném období bylo v databázi MIND léčeno pegylovaným interferonem alfa‑2a celkem 262 pacientů, kteří trpěli nežádoucími účinky v 92 % případů, výjimkou nebyly ani grade 3, a léčbu z důvodu toxicity ukončilo 26 %,“ upozornila.
Ropeginterferon alfa‑2b v klinické praxi
Změně paradigmatu léčby PV po příchodu ropeginterferonu alfa‑2b do klinické praxe se věnovala MUDr. Petra Bělohlávková, Ph.D., ze IV. interní hematologické kliniky LF UK a FN Hradec Králové: „Látka podobně jako jiné interferony inhibuje proliferaci hematopoetických buněk a progenitorových buněk fibroblastů kostní dřeně. Zároveň antagonizuje působení růstových faktorů a cytokinů, čímž omezuje riziko rozvoje fibrózy. Kromě toho má ale oproti HU a jiné starší terapii schopnost modifikovat průběh onemocnění, kdy po pěti letech léčby dosáhlo 54 % pacientů snížení JAK2 alelické nálože pod deset procent, a pětina dokonce pod jedno procento, ve srovnání s HU, kde se to zdařilo jen přechodně, a to u 1,4 % pacientů. Látka tím výrazně pomáhá předcházet riziku progrese PV do sekundární myelofibrózy. To je zejména významné u mladších, nízce rizikových pacientů v počátečních fázích choroby. Podávání ropeginterferonu alfa‑2b u nich má potenciál stabilizace, a dokonce molekulární regrese onemocnění. Výhodou je rovněž fakt, že na rozdíl od HU nepotencuje vznik sekundárních malignit,“ popsala a dodala: „Vedle dosud k cytoredukční léčbě naivních pacientů by mělo být podávání ropeginterferonu alfa‑2b zváženo jako záměna také u většiny pacientů na HU. Jedná se především o ty, kteří léčbu netolerují nebo je u nich nedostatečně účinná, respektive mohou profitovat z modifikace průběhu onemocnění. U mladších, nově diagnostikovaných pacientů ale platí, že bychom se měli léčbou ropeginterferonem alfa‑2b snažit rovnou začít a HU přeskočit. V každém případě by ovšem terapie měla být individualizována na míru každému nemocnému.“
Mutace JAK2
Problematiku mutací JAK2 podrobněji vysvětlil prof. MUDr. Michael Doubek, Ph.D., z Interní hematologické a onkologické kliniky LF MU a FN Brno: „U pacientů s Ph– myeloproliferativními onemocněními se mutace vyskytují u více než 90 %, identifikováno bylo více než 30 genů s nimi spojených. Ty většinou řídí procesy jako přenos signálu, RNA splicing, DNA metylace nebo modifikace histonů. Získání mutace přitom může výrazně předcházet vlastnímu onemocnění. Nejčastější mutací, která se objevuje u klonální hematopoezy při PV, je JAK2 V617F. Každá buňka má pro gen, ve kterém vzniká, dvě alely, postupně se rozvíjí nejdřív v jedné (heterozygotní mutace) a případně i v druhé z nich (homozygotní mutace). Počet postižených buněk, respektive alel, postupně stoupá a jejich procentuální postižení vyjadřuje právě alelická nálož. Zároveň se mohou rozvíjet i jiné přídatné mutace a onemocnění je stále více heterogenní. Kvantita postižení JAK2 se odráží do hodnot krevního obrazu a koreluje nejen s hematokritem, ale i s leukocytózou, méně s trombocytózou. Vyšetřovat JAK2 V617F v průběhu onemocnění je důležité pro stanovení úspěšnosti léčby a pro budoucí nové léčebné možnosti, včetně jejich kombinací. Alelická nálož JAK2V617F nad 50 % potom představuje již pokročilé onemocnění a může progredovat do sekundární myelofibrózy nebo akutní myeloidní leukémie, zároveň vede ke zvýšenému riziku tromboembolických komplikací bez ohledu na věk, vyšším koncentracím jaterních transamináz nebo k vyššímu riziku splenomegalie. Zatímco při alelické náloži pod 50 % je 15leté přežití bez myelofibrózy 100 %, při vyšší náloži jen 40 %. Ropeginterferon alfa‑2b a jiné pegylované interferony mají schopnost modifikovat průběh choroby, a tím nárůst alelické nálože mutací JAK2 nejenom zastavit, ale dokonce její hodnotu regredovat, na zdravou krvetvorbu ale nemají negativní vliv. Dochází tak k selektivnímu ovlivnění maligního klonu při zachování fyziologické krvetvorby. Ve studiích PROUD PV a CONTINUATION PV došlo během pěti let k poklesu procentuální alelické nálože JAK2V617F z původních průměrných 36 % na osm procent, v kontrolní větvi s HU naopak stoupla z 37 % na 44 %, což se v aktivní větvi odrazilo do prodloužení přežití bez příhod. Podle dostupných dat se ukazuje, že při prosté venepunkci dochází ke zvyšování JAK2 alelické zátěže asi o jedno procento ročně, stejně jako při léčbě HU, kterou může provázet přechodné snížení. Podávání ropeginterferonu alfa‑2b ale vede ke konzistentní redukci nálože o asi jedno procento za každý měsíc léčby,“ vysvětlil.
Prof. Doubek se věnoval výhodám ovlivnění průběhu choroby podrobněji: „30,4 % pacientů, kteří dostávali ropeginterferon alfa‑2b (oproti 4,2 % v kontrolním rameni; p < 0,0001), splňovalo v 60. měsíci následující přísná kritéria a mohlo u nich být zváženo ukončení léčby. Pravidla zahrnula alelickou nálož JAK2V617F pod 10 %, trvalou kompletní hematologickou odpověď (hematokrit < 45 % bez flebotomie v posledních 3 měsících, počet trombocytů < 400 × 109/l a počet leukocytů < 10 × 109/l; vysazení se považuje za non‑respondéry) po dobu ≥ 2 roky a dále žádnou progresi onemocnění, tromboembolickou příhodu nebo zhoršení příznaků či symptomů souvisejících s onemocněním po celou dobu léčby. Vysazení léčby je zatím předmětem klinického výzkumu, tento postup nicméně podpořila recentně uveřejněná metaanalýza autorů Chen et al. z časopisu Annals of Hematology. Ta zahrnula celkem 381 pacientů s myeloproliferativním onemocněním léčených interferonem a ukázala, že přibližně 50 % pacientů, kteří dosáhli CHR a alelické nálože JAK2V617F nižší než 10 %, nemělo relaps po dobu nejméně deseti let po ukončení léčby,“ sdělil a dodal: „Léčba PV, která nesleduje klonální expanzi JAK2 V617F a nesnižuje alelickou nálož JAK2V617F, neřeší riziko trombózy nebo progrese onemocnění, představuje pro pacienty promarněnou příležitost získat léčbu modifikující biologickou podstatu choroby. Léčba PV sice vyžaduje roky expozice k dosažení molekulární odpovědi, ta ale může být při použití ropeginterferonu alfa‑2b dobře snášena, bez těžké imunosuprese a rizika rozvoje nádorového onemocnění.“