Antikoagulancia v ordinaci praktického lékaře
Úvod
Antikoagulační terapie svým zásahem v koagulačním systému brání narůstání a recidivě žilní či arteriální trombózy. Základní doporučení o jejich užívání v klinické praxi vycházejí z doporučení České společnosti pro trombózu a hemostázu (ČSTH) a dalších odborných společností. Základní součástí při indikaci a provádění antikoagulační terapie je zhodnocení poměru aktuálního rizika krvácení a rizika tromboembolické příhody, která jsou u každého pacienta individuální a jsou dána součtem vrozených a získaných rizikových faktorů. Významné je i zhodnocení ostatních léků, které mohou zvyšovat krvácení nebo zesilovat účinek antikoagulancií. Dále je nutné zhodnocení chorob, které mohou ovlivnit hemostázu (poruchy ledvin, jaterní, kardiovaskulární nebo hematoonkologická onemocnění). Antikoagulační léčba znesnadňuje operační výkony u nemocných, kteří ji užívají. Podávání warfarinu je nutné přerušit několik dní před plánovanou operací, u pacientů s vysokým rizikem trombózy je navíc vhodné překlenout toto období nízkomolekulárním či nefrakcionovaným heparinem. Přímá perorální antikoagulancia (DOAC) mají významně kratší biologický poločas než warfarin, jejich účinek je tedy možné lépe odhadnout a ukončit jejich podávání až těsně před operací; překlenovací terapie tak ve většině případů není nutná.
Riziko žilního tromboembolismu a vzniku závažných krvácení
Pro perioperační postup je nutné posoudit riziko žilního tromboembolismu (TEN) při přerušení antikoagulační léčby, současně také stanovit riziko potenciálních krvácivých komplikací spojených s operačním/invazivním výkonem, posoudit dobu vysazení antikoagulační léčby a ev. nutnost zavedení překlenovací léčby, nejčastěji s nízkomolekulárními hepariny (LMWH). Riziko TEN zvyšuje samotný operační výkon (tab. 1), ale i další faktory typu fibrilace síní, zavedená mechanická chlopenní náhrada nebo recentní žilní nebo tepenná trombóza.
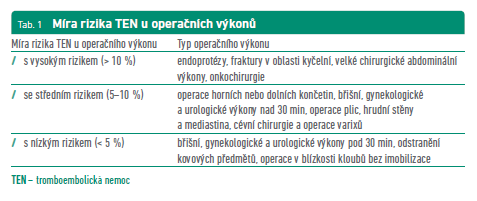
Kumulativní riziko TEN příhody u pacientů s fibrilací síní (FiS) lze s vysokou pravděpodobností odhadnout podle skórovacího rizika CHA2DS2‑VASc (tab. 2). Pacienti se skóre CHA2DS2‑VASc minimálně 2 body mají roční riziko recidivy větší než 10 procent a jsou indikováni k dlouhodobé antikoagulační terapii. U pacientů s porevmatickým chlopenním onemocněním a FiS je vysoké riziko TEN. U nemocných se skóre 1 se antikoagulační léčba spíše doporučuje.

Riziko recidivy TEN je nejvyšší po vysazení antikoagulační léčby během prvních tří měsíců po trombotické příhodě a pohybuje se u těchto pacientů nad 10 % ročně. Další skupinou nemocných se zvýšeným rizikem TEN jsou pacienti na antikoagulační léčbě pro prodělané manifestaci TEN (hluboká žilní trombóza – HŽT nebo plicní embolizace – PE) a s aktivní formou nádorového onemocnění. U nich je roční riziko recidivy TEN cca 15 %. Po prodělané TEN je velmi vysoké riziko recidivy TEN v prvním měsíci a operační výkon je v této době kontraindikován s výjimkou výkonů prováděných z vitální indikace. Proto se doporučuje plánovaný výkon odložit na dobu 3–6 měsíců (podle naléhavosti) od manifestace TEN. Specifickou skupinou jsou pacienti s TEN, u nichž byl zjištěn zhoubný nádor řešitelný operací (1–3 měsíce od vzniku TEN). U nich je indikováno zavedení dočasného kaválního filtru a dále pokračovat dle současných doporučení s podáváním LMWH.
Další velmi rizikovou skupinu představují pacienti s významnými trombofilními stavy (deficit inhibitorů koagulace: protein C, protein S, antitrombinu, pacienti s antifosfolipidovým syndromem nebo pacienti s významnými geneticky determinovanými trombofilními stavy – homozygotní mutace FV Leiden nebo FII protrombin nebo jejich kombinace v heterozygotních formách). U této skupiny pacientů je doporučováno konzultovat perioperační postup se specialisty na trombofilní stavy.

Ke zhodnocení rizika vzniku větší krvácivé komplikace slouží skóre HAS‑BLED (tab. 3). Pacient by měl vždy svého praktického lékaře informovat o příznacích, které mohou souviset s podávanou antikoagulační léčbou, a to zejména:
- neztišitelné krvácení z rány,
- krvácení z nosu,
- krvácení z dásní při čištění zubů,
- krev ve stolici,
- jakékoliv neobvyklé příznaky, jako jsou bolest, svědění či neklid.
Používaná antikoagulancia v ČR můžeme dle jejich účinku dělit na 4 základní skupiny
- Hepariny (nefrakcionovaný standardní heparin – UHF a nízkomolekulární hepariny – LMWH, low molecular weight heparin) a selektivně působící inhibitor aktivovaného FXa (syntetický pentasacharid fondaparinux), které jsou aplikovány injekčně.
- Kumarinové preparáty (antagonisté vitaminu K – warfarin), používané perorálně.
- Přímé inhibitory trombinu (hirudin a podobné látky, např. bivalirudin) s injekční nebo perorální formou podání.
- Přímá perorální antikoagulancia (DOAC), tj. perorální přímé inhibitory faktoru Xa (rivaroxaban – Xarelto, apixaban – Eliquis, edoxaban – Lixiana) a trombinu (dabigatran etexilát – Pradaxa).
Léky ve 3. a 4. skupině řadíme mezi přímé inhibitory koagulačních faktorů, protože ke své aktivitě (s výjimkou idraparinuxu) nepotřebují kofaktory a působí selektivně v místě koagulační kaskády. Z hlediska běžné ambulantní antikoagulační praxe je nejvýznamnější používání warfarinu, LMWH, pentasacharidů a DOAC.
Antagonista vitaminu K (warfarin)
S antikoagulační terapií formou antagonistů vitaminu K (VKA) jsou zatím v klinické praxi stále největší zkušenosti. Používá se v mnoha indikacích (dle SPC):
- Léčba a prevence hluboké žilní trombózy a plicní embolie.
- Sekundární prevence infarktu myokardu a prevence tromboembolických komplikací (iktus nebo systémová embolie) po infarktu myokardu.
- Prevence tromboembolických komplikací (iktus nebo systémová embolie) u pacientů s fibrilací síní, onemocněním srdečních chlopní nebo s náhradou srdečních chlopní.
- Léčba a prevence tranzitorních ischemických atak (TIA) a iktu.
Cílové terapeutické rozmezí INR (mezinárodní normalizovaný poměr) u warfarinizace je u všech indikacích 2,5 +/–0,5. U profylaxe tromboembolických komplikací u pacientů s náhradou srdeční chlopně je doporučena hodnota INR 3,0 +/–0,5.
Přenosná zařízení stanovení hodnoty INR (POCT‑INR) a jejich používání v ambulantním prostředí (nejčastěji u praktického lékaře) nabízí bezprostřední informaci o výsledku INR a okamžitou možnost úpravy dávkování (resp. předoperační načasování vysazení) warfarinu.
Aktuální doporučení pro perioperační postup při warfarinizaci se řídí mírou rizika krvácení. Během přemosťující parenterální antikoagulační léčby je třeba před operací vyhodnotit riziko krvácení, provést klinické a laboratorní vyšetření hemokoagulace (krevní obraz, INR, aPTT). Preoperační, perioperační a pooperační antikoagulační léčbu s warfarinem je možné provádět podle následujícího rozpisu: INR se stanovuje týden před plánovaným chirurgickým nebo specifickým invazivním zákrokem. Léčba warfarinem se přerušuje jeden až pět dnů před chirurgickým nebo určeným invazivním zákrokem podle hodnot INR. Délka přerušení léčby warfarinem závisí na hodnotě INR a platném doporučení. U pacientů se zjištěným vysokým rizikem TEN se jako profylaxe používá subkutánně aplikovaná adekvátní dávka LMWH 1× denně, při velmi vysokém riziku TEN je nutné aplikovat adekvátní terapeutické dávky LMWH 2× denně. Dávkování je u jednotlivých přípravků LMWH popisováno dle SPC. Podávání warfarinu se přerušuje pět dnů před chirurgickým zákrokem, je‑li INR > 4,0, tři dny před chirurgickým zákrokem, je‑li hodnota INR = 3,0–4,0, dva dny před chirurgickým zákrokem, je‑li INR = 2,0–3,0; INR se stanovuje večer před chirurgickým zákrokem a podává se 0,5 mg až 1 mg vitaminu K perorálně nebo intravenózně, je‑li hodnota INR > 1,8. V den operace je třeba zvážit nutnost podání infuze nefrakcionovaného heparinu nebo profylakticky LMWH. Následujících pět až sedm dnů po chirurgickém zákroku se pokračuje v subkutánní aplikaci LMWH souběžně se znovuzavedením léčby warfarinem. V podávání warfarinu se pokračuje běžnou udržovací dávkou večer po menším chirurgickém zákroku a ode dne, kdy je pacientovi poprvé aplikována parenterální výživa, po velkém chirurgickém zákroku. Při urgentních výkonech musí být účinek VKA co nejrychleji zrušen, nejčastěji nitrožilním podáním 10 mg vitaminu K1 (působí během cca 24 hodin) nebo substitucí příslušných koagulačních faktorů (protrombinový komplex [PPSB], působící během několika minut). Ponechání léčby VKA u pacientů s nízkým rizikem krvácení a stabilní hodnotou INR 2,5 +/–0,5 je možné u jednoduchých stomatologických výkonů (extrakce zubů), operací katarakty, dermatologických intervencí (např. malá kožní excize), artrocentéz nebo endoskopických vyšetření gastrointestinálního traktu (bez biopsie) a v kardiologii u provádění implantace kardiostimulátoru a kardioverteru‑defibrilátoru (PM/ICD), provedení katetrizační ablace fibrilace síní, u selektivní koronarografie (SKG) a u perkutánní koronární intervence (PCI) při radiálním vstupu.
Pooperační nasazení warfarinizace musí být individualizováno. Pokud nedochází k abnormálním krevním ztrátám, podává se profylaktická dávka LMWH za 6–12 hodin po operaci, u pacientů s vysokým rizikem z hlediska TEN se pak podává terapeutická dávka LMWH za 48–72 hodin po operaci (pokud nejsou krevní ztráty) a současně je zahájeno podávání warfarinu v původní dávce (první den možno podat dávku dvojnásobnou) a po dosažení terapeutického rozmezí INR je možno ukončit podávání LMWH.
Přímá orální antikoagulancia
Přímá orální antikoagulancia (DOAC) mají oproti warfarinu několik výhod. Jejich účinek nastupuje rychle a relativně rychle odeznívá. Mají široké terapeutické okno. Mají podstatně méně lékových interakcí, jejich účinek není prakticky ovlivněn složením potravy. Mechanismem účinku DOAC je přímá inhibice specifického koagulačního faktoru – v případě dabigatranu inhibice trombinu a v případě xabanů inhibice koagulačního faktoru Xa. Nástup jejich maximálního účinku je rychlý, cca 1,5–4 hodiny po požití. Při terapii TEN je možné zahájit terapii s rivaroxabanem a apixabanem přímo, u dabigatranu a edoxabanu je nutné předléčení LMWH.
DOAC v ČR – současné indikace (SPC):
- Prevence žilního tromboembolismu (VTE) u dospělých pacientů podstupujících elektivní operativní náhradu kyčelního nebo kolenního kloubu (vyjma edoxaban).
- Léčba hluboké žilní trombózy (HŽT) a hemodynamicky stabilní plicní embolie (PE) a prevence jejich recidivy.
- Prevence ischemické cévní mozkové příhody a systémové embolizace u pacientů s nevalvulární fibrilací síní s jedním nebo více rizikovými faktory (kardiální kongesce, hypertenze, věk nad 75 let, diabetes mellitus, stav po iCMP/TIA).
- Součást prevence aterotrombotických příhod u pacientů po akutním koronárním syndromu (AKS) (jen rivaroxaban).
- Součást prevence aterotrombotických příhod u pacientů s ischemickou chorobou srdeční (ICHS) nebo se symptomatickým onemocněním periferních tepen (PAD) (jen rivaroxaban).
- Léčba VTE a prevence recidivujících VTE u pediatrických pacientů od narození do věku 18 let (jen rivaroxaban, dabigatran).
Indikace a dávkování DOAC, se zohledněním úhradových podmínek zdravotních pojišťoven, jsou v současné době v ČR vymezeny pouze u příslušných odborností mimo praktické lékaře.
Péče o pacienty s DOAC v případě chirurgického/invazivního výkonu
Při posouzení doby, kdy je nutné DOAC před výkonem vysadit, je třeba vzít do úvahy urgentnost zákroku, riziko krvácení spojeného s výkonem, aktuální renální funkce a typ užívaného DOAC. Ve srovnaní s warfarinem mají DOAC více předvídatelnou farmakokinetiku, farmakodynamiku, rychlejší nástup účinku a významně kratší poločas. Jejich poločas je závislý na funkci ledvin a v případě apixabanu či rivaroxabanu i na jaterních funkcích. Vzhledem k uvedenému je doba nezbytného přerušení antikoagulační léčby předoperačně v porovnání s warfarinem kratší. V případě urgentních výkonů je třeba zvážit odložení výkonu, než odezní antikoagulační efekt daného přípravku. Vzhledem ke krátkému biologickému poločasu přímých perorálních antikoagulancií není nutná v perioperačním období přemosťovací léčba s LMWH, protože stačí lék vysadit krátce před chirurgickým výkonem.
Vysazení DOAC v případě operace/invazivních výkonů a při spinální/epidurální anestezii (SPC data)
Rivaroxaban (Xarelto): doporučovaná doba vysazení min. 24 hodin předem. Při spinální/epidurální anestezii nebo punkci by odstranění epidurálního katétru mělo být na základě farmakokinetických vlastností provedeno nejméně po době představující dvojnásobek poločasu, to je u mladých pacientů nejméně 18 hodin a u starších pacientů 26 hodin po posledním podání rivaroxabanu. Další dávka rivaroxabanu se nepodává dříve než šest hodin po vyjmutí katétru. Pokud dojde k traumatické punkci, podávání rivaroxabanu se odloží o 24 hodin.
Apixaban (Eliquis): doporučovaná doba vysazení je nejméně 24 hodin předem (u pacientů s nízkým rizikem krvácení) a nejméně 48 hodin (u pacientů se středním nebo vysokým rizikem krvácení). Zavedené epidurální nebo intratekální katétry musejí být odstraněny nejméně pět hodin před první dávkou apixabanu, měla by být prodleva v intervalu 20–30 hodin (tj. dvojnásobek poločasu) mezi poslední dávkou apixabanu a odstraněním katétru a před odstraněním katétru by se měla vynechat nejméně jedna dávka. Další dávka apixabanu se může podat nejméně pět hodin po odstranění katétru.
Edoxaban (Lixiana): doporučovaná doba vysazení je nejméně 24 hodin předem. Edoxaban se má po chirurgických či jiných zákrocích začít znovu podávat, jakmile je zajištěna odpovídající hemostáza, doba do nástupu antikoagulačního léčebného účinku je 1–2 hodiny. Není‑li možné podávat v průběhu chirurgické intervence nebo po ní perorální léčivé přípravky, má se zvážit podání parenterálního antikoagulancia. Pro spinální anestezii/epidurální anestezii/lumbální punkci nemá edoxaban údaje v SPC.
Dabigatran (Pradaxa): doporučovaná doba vysazení je nejméně 24 hodin předem (běžný výkon/renální funkce CrCL v ml/min ≥ 80), nejméně 2–3 dny předem (rozsáhlý výkon/vysoké riziko krvácení/CrCL v ml/min ≥ 50 – < 80) a 4 dny předem (rozsáhlý výkon/vysoké riziko krvácení/CrCL v ml/min ≥ 30 – < 50). Pokud se jedná o akutní výkon, doporučuje se zjistit podání poslední dávky a odložit výkon min. o 12 hodin nebo je možné podat antidotum (Idarucizumab/Praxbind). Po odstranění katétru (spinální/epidurální anestezie) je nutný nejméně dvouhodinový interval před podáním první dávky dabigatranu.
Pokud je po operačním zákroku dosaženo adekvátní chirurgické hemostázy, je možno DOAC opětovně nasadit. V případě nízkého rizika krvácení je možno DOAC nasadit 24 hodin po zákroku. U výkonu s vysokým rizikem krvácení je doporučeno počkat 48 hodin po chirurgickém zákroku. Léčbu DOAC není nutno přerušovat (neprovádět však v době jejich vrcholné aktivity – za 2–4 hod.) při kardioverzi, drobné kožní incizi, nekomplikované extrakci zubu, endoskopii bez biopsie či po operačním zákroku pro kataraktu či glaukom. Provedení ablace upravují doporučení České kardiologické společnosti.
Není‑li známa doba, kdy pacient naposledy užil lék, a intervence spojená s vysokým rizikem krvácení je nezbytně nutná, musí se stanovit koncentrace léku v krvi pomocí příslušných kalibrovaných testů k jednotlivým přípravkům (tab. 4).
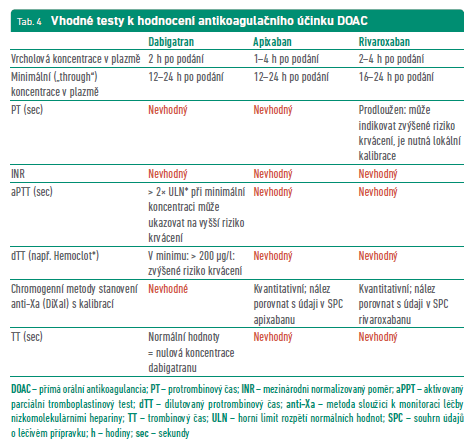
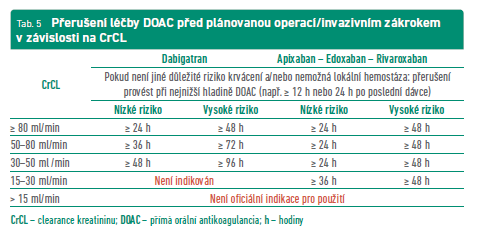
U plánovaných výkonů vycházíme z odhadu rizik krvácení spojených s výkonem a s posouzením renálních funkcí. Před výkonem s nízkým rizikem je možno vynechat DOAC po dobu 2–3 jejich poločasů. V případě výkonu s vysokým rizikem se doporučuje prodloužit dobu vysazení až na 4–5 poločasů jednotlivých přípravků. Tuto dobu je však třeba upravit dle renálních funkcí (tab. 5).
Nízkomolekulární hepariny
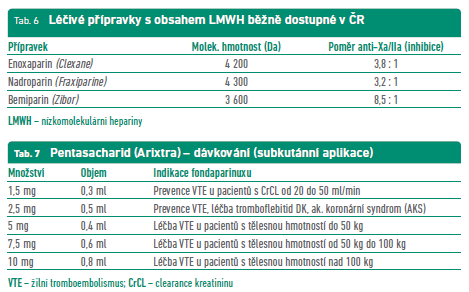
Nízkomolekulární hepariny (LMWH) se významně váží na antitrombin a tím selektivněji inhibují faktor Xa (FXa), zvyšují fibrinolýzu, snižují hladinu inhibitoru aktivátoru plazminogenu (PAI), zvyšují hladinu inhibitoru tkáňového faktoru a tím inhibují tkáňový faktor a zevní koagulační systém. LMWH jsou standardizovány podle inhibiční aktivity k FXa. Léčba s LMWH díky jednoduché aplikaci s přesným množstvím antitrombotika a delšímu poločasu výhodnější než u nefrakciovaného heparinu (NFH). Při s.c. (podkožní) aplikaci LMWH většinou odpadá nutnost laboratorních kontrol a hodí se i pro domácí samoaplikaci. V porovnání s NFH je u LMWH méně nežádoucích reakcí, zejména HIT (heparinem‑indukovaná trombocytopenie) a osteoporózy. Souhrnně jsou hlavními přednostmi LMWH spolehlivý antikoagulační efekt, rychlý nástup účinku, dobrá tolerance, minimální riziko lékových interakcí a v neposlední řadě cenová dostupnost (tab. 6).
K přesnému hodnocení antitrombotického účinku LMWH je třeba použít stanovení výše inhibice FXa v citrátové plazmě. Při s.c. aplikaci je třeba odebrat krev na vyšetření inhibice FXa za 4 hodiny po s.c. aplikaci LMWH, tedy v čase očekávaného maxima plazmatické koncentrace. Antikoagulační účinek lze kontrolovat stanovením anti‑Xa aktivity, a to zejména v těchto případech: osoby s velmi nízkou a velmi vysokou hmotností (body mass index – BMI > 40, resp. > 150 kg; ženy < 45 kg a muži < 57 kg), s renální insuficiencí (LMWH se vylučuje ledvinami), CrCL < 30 ml/min (0,5 ml/s), v graviditě (měnící se hmotnost během gravidity, riziko poddávkování) nebo u onkologických pacientů s vysokým rizikem komplikací (tromboembolie/krvácení). Doporučované referenční rozmezí anti‑Xa je 0,2–0,4 IU/ml při profylaktické dávce (1× denně s.c.) a 0,5–1,2 IU/ml při terapeutické dávce (2× denně s.c.). Některé rozdíly u jednotlivých přípravků s LMWH mohou mít klinický význam (účinnost, délka působení, eliminace, tolerance…), jiné význam pravděpodobně nemají (rozdíly v dostupnosti po podkožním podání, citlivost monitorování aktivity anti‑Xa nebo vazba na plazmatické proteiny). Budeme‑li chtít porovnat jednotlivé LMWH navzájem, je účelné zohlednit farmakodynamické vlastnosti, farmakokinetické vlastnosti, klinický efekt, indikace, toleranci, náklady a v neposlední řadě jednoduchost určování dávky.
Syntetický pentasacharid fondaparinux
Fondaparinux (Arixtra) se neváže na destičkový faktor 4 a nereaguje zkříženě se sérem od pacientů s heparinem indukovanou trombocytopenií (HIT) typu II a je zde možnost využití antikoagulační terapie místo LMWH. Současnými terapeutickými indikacemi v ČR jsou prevence žilních tromboembolických příhod (VTE) u dospělých pacientů podstupujících závažnější ortopedický zákrok na dolních končetinách, jako např. v případě zlomeniny kyčle, závažnější operace kolena nebo náhrady kyčelního kloubu, dále prevence žilních tromboembolických příhod u dospělých pacientů podstupujících břišní operaci, kde se předpokládá vysoké riziko tromboembolických komplikací, jako jsou např. pacienti podstupující operaci zhoubného nádoru v břišní dutině, a prevence žilních tromboembolických příhod u dospělých pacientů s interním onemocněním, u kterých se usuzuje na vysoké riziko VTE a kteří jsou nepohybliví kvůli akutní chorobě, jako je např. srdeční nedostatečnost a/nebo akutní respirační onemocnění, a/nebo akutní infekce nebo zánětlivé onemocnění. Další je i léčba akutní symptomatické spontánní tromboflebitidy dolních končetin (DK) bez současné flebotrombózy u dospělých. V ambulantní praxi je v této indikaci významné, že pokud je tromboflebitida delší než 5 cm a současně ve vzdálenosti 3–10 cm od safenofemorální či safenopopliteální junkce, je přípravek hrazen zdravotními pojišťovnami, a to nejdéle na 45 dnů. Dávkování uvádí tabulka 7.
Závěr
Antikoagulačně působící přípravky jsou dnes s výhodou používány v mnoha preventivních i léčebných režimech u mnoha skupin pacientů. V ambulantní praxi je u jednotlivých přípravků účelné zohlednit farmakodynamické i farmakokinetické vlastnosti, klinický efekt, indikace, toleranci, náklady, compliance pacienta a v neposlední řadě i jednoduchost dávkování. V článku je uveden přehled praktického postupu perioperační péče u pacientů na perorální antikoagulační léčbě. Je nutné znovu zopakovat, že v případě plánovaného/urgentního operačního výkonu je vždy nutné u pacienta s perorální antikoagulační terapií individuálně vyhodnotit poměr mezi rizikem krvácení a rizikem tromboembolické příhody a dle příslušného rizika pak volit další postup. Pro monitoraci hodnot INR v ambulantní praxi při warfarinizaci je možné rutinně využívat spolehlivé POCT‑INR přístroje. Pacienti, kteří užívají DOAC, potřebují přerušit užívání léku určitou dobu před elektivním chirurgickým výkonem v závislosti na biologickém poločase léku a na funkci ledvin. Určité omezení v současné době představuje limitace indikací a úhrad DOAC pro praktické lékaře.
Práce byla podpořena projektem RVO‑VFN64165.
Použitá literatura k dispozici u autora.